Визначення електрохімічного еквівалента міді
Лабораторна робота №14
Мета роботи: Навчитися досвідченим шляхом визначати електрохімічний еквівалент міді.
Теорія: Процес, при якому молекули солей, кислот і лугів при розчиненні у воді або в інших розчинниках розпадаються на заряджені частинки, (іони), називається електролітичної дисоціацією; вийшла при цьому розчин з позитивними і негативними іонами називається електролітом. Якщо в посудину з електролітом помістити пластини (електроди) з'єднані з зажимами, джерелами струму (створити в електроліті електричне поле), то позитивно заряджені іони будуть рухатися до катода, а негативні до анода. У електродів відбувається окислювально-відновні реакції, при цьому на електродах виділяються речовини-продукти реакції.
Для електролізу справедливий закон Фарадея: маса виділився речовини на електроді прямо пропорційна заряду Q пройшов через електроліт: m = QK або m = IKt, де K- електрохімічний еквівалент- кількість речовини, виділене при проходженні через електроліт одного кулона електрики. Для кожної речовини значення K- є постійна величина. Вимірявши силу струму в ланцюзі, складеної за схемою, час його проходження і маси виділився на катоді речовини можна визначити електрохімічний еквівалент. З 1 закону Фарадея Kx (m) = Mm / It (кг / кл)
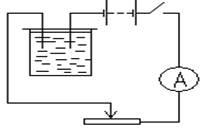
Обладнання: 1. джерело електричної енергії (випрямляч ВС - 4-12 або батарея акумуляторів; 2. мідні пластини (2 шт.); 3. електролітична ванна з розчином мідного купоросу; 4. амперметр; 5. ключ; 6. з'єднувальні дроти; 7. ваги і важок; 8. реостат; 9. годинник; 10. вентилятор настільний або електроплитка; 11. наждачний папір.
1) Ретельно очищену поверхню мідної пластинки наждачним папером зважити на терезах з максимально можливою точністю.
2) Зібрати електричне коло за схемою, зображеної на рис. Зважену пластинку з'єднати з негативним полюсом джерела електричної енергії.
3) Після перевірки ланцюга викладачем помітити час по годинах з секундною стрілкою, замкнути ключ. Швидко встановити реостатом силу струму 1-1,5 А. Користуючись реостатом, підтримувати силу струму незмінною протягом усього досвіду.
4) Через 8-10 хвилин ланцюг розімкнути. Платівку, що служила в досвіді катодом, вийняти, обережно обполоснути водою, висушити перед вентилятором або електроплиткою, ретельно зважити і визначити масу виділилася міді.
5) За результатами вимірювань визначити електрохімічний еквівалент міді.
6) Порівняти знайдене значення електрохімічного еквівалента міді з табличними та визначити відносну похибку вимірювань.
7) Результати вимірювань записати в таблицю.
Маса катода до опитаmК, кг
Маса катода після опитаMМК, кг
KХ = mМ / It = 2 × 10 -3 / 0,7 × 900 = 3,174 × 10 -7 кг / Кл
= 3,174 × 10 - 7 -3,294 × 10 -7 / 3,294 * 10 -7 × 100% = 3,6%
1) Чому молекули кислоти лугу і солі у воді розпадаються на іони?
2) Чому з підвищенням температури опір електроліту зменшується?
3) Чи буде відбуватися електрична дисоціація в умовах космічного польоту?
4) За яких умов концентрація електроліту в процесі електролізу не змінюється?
5) Як слід вчинити, якщо, помилково при виконанні досвіду зі зважування пластинки, катод був з'єднаний з позитивним полюсом джерела струму?
6) Як надходять коли необхідно до вугільного електрода припаяти дріт?
Відповіді на контрольні питання.
1) Тому що молекула води являє собою диполь і може розтягнути заряджені іони цих речовин.
2) Опір електроліту з підвищенням температури зменшується, тому що збільшується швидкість руху іонів-основних носіїв заряду в електролітах.
3) Так, електролітична дисоціація в умовах космічного польоту відбувається.
4) За умови, що на аноді виділяється в розчин стільки ж металу, скільки осідає на катоді і в ході електролізу не виділяється газ.
5) Треба з початкової маси анода відняти його масу після електрохімічної дисоціації. Так можна дізнатися, скільки міді пішло з платівки в розчин і ця маса дорівнює масі осіла на катоді міді.
6) За допомогою електрохімічної дисоціації осадити на вугільний електрод, який - або метал, а потім до нього припаяти дріт.
Висновок: Я навчився досвідченим шляхом визначати електрохімічний еквівалент міді.