Вивчення електропровідності рідин і визначення електрохімічного еквівалента міді
Мета і завдання роботи: Вивчення механізму проходження струму в електролітах і законів електролізу, проведення електролізу і визначення електрохіміческoго еквівалента міді.
Речовини, водні розчини яких проводять електричний струм, називаються електролітами. На відміну від металів, що мають електронну провідність і напівпровідників, що мають електронно-дірковий провідність, електроліти мають іонною провідністю.
Іноді електролітами називають і самі проводять розчини, хоча правильніше вираз - розчин електроліту.
Молекули води в незначній мірі розпадаються на іони:
Концентрація іонів водню визначає кислотність розчину, а концентрація іонів гідроксилу характеризує лужність розчину. У чистій воді концентрації іонів Н + і ОН - рівні. Чиста вода дисоціює дуже слабо. В 1 моль води при 22º С розпадається на іони всього моль.
Однак отримати таку воду дуже важко, тому що в повітрі завжди присутня вуглекислий газ, який, розчиняючись воді, збільшує концентрацію водневих іонів. Так як вода має велику діелектричну проникність () і молекули води мають значний дипольний момент (Кл # 8729; м), то навколо молекул води на міжатомних відстанях (нм) існує досить сильне електричне поле. Останнє є безпосередньою причиною, що ослаблює силу електростатичного притягання іонів в молекулах розчиненої речовини. Тому в процесі розчинення солі або лугу за рахунок теплових зіткнень відбувається розпад молекул на аніони і катіони. Якщо молекули розчиненої речовини у воді не дисоціюють на іони, то розчин не є провідником. Наприклад, водні розчини цукрів, гліцерину - ізолятори.
Результатом дисоціації є утворення сольватов (гідратів), коли молекули води «обволікають» іони, утворюючи навколо них сольватную оболонку (рисунок 1).
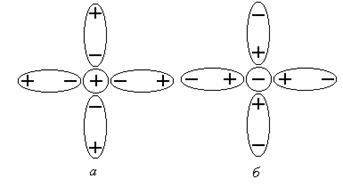
Малюнок 1 сольватного оболонки: а - катіона; б - аніону
Для виникнення електричного струму в електроліті, необхідно в ванну з розчином електроліту опустити електроди з провідного матеріалу (метал, вугілля і т.п.), до яких підключити джерело струму (рисунок 2). Такий пристрій називається гальванічною або електролітичної ванній.
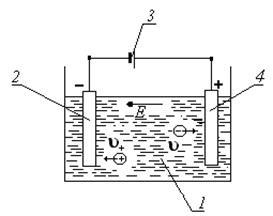
Малюнок 2 Електролітична ванна: 1 - ванна з розчином
мідного купоросу; 2 - катод; 3 - джерело струму; 4 - анод;
і - швидкості позитивних і негативних іонів
На іон в електроліті діють дві сили: сила з боку електричного поля і сила опору руху з боку середовища. Сила, що діє з боку електричного поля, обчислюється за формулою:
де - заряд іона, Кл; - напруженість електричного поля,.
Сила. обумовлена взаємодією молекул, які оточують іон, пропорційна швидкості:
де - коефіцієнт опору руху іонів в середовищі.
При русі іона в електроліті між силами швидко встановлюється рівновага і рух іона між електродами можна розглядати як рівномірний і прямолінійний, тому:
Якщо позначити. то. Коефіцієнт b називається рухливістю іонів. Фізичний сенс рухливості в тому, що вона характеризує швидкість іонів в електроліті при напруженості електричного поля Е = 1.
Так як струм в електролітах являє собою впорядкований рух іонів обох знаків, обумовлене дією зовнішнього електричного поля, то щільність струму в електроліті визначається виразом:
де n + і - - концентрації катіонів та аніонів; + І - - - швидкості їх дрейфу, + і - - їх заряди.
Відбуваються на катоді і на аноді окислювально-віднови-тільні реакції підкоряються законам Фарадея.
Перший закон. маса виділився на електроді речовини пропорційна Запобігати через електроліт заряду:
де - електрохімічний еквівалент; I - сила струму, А; t - час, с.
Електрохімічні еквіваленти ряду елементів наведені в таблиці 1.
Таблиця 1 Значення електрохімічних еквівалентів
для деяких речовин
Другий закон. електрохімічні еквіваленти елементів прямо пропорційні їх хімічним еквівалентів:
де F - число Фарадея (F = 96500); M - молярна маса виділився на електроді речовини; n - його валентність, - хімічний еквівалент.
Продукти електровідновлення або електроокислення іонів електроліту можуть вступити в хімічні реакції з розчином поблизу електрода. Такі процеси називаються вторинними реакціями.
Всі ці процеси знаходять застосування в різних галузях техніки, багато хто з них використовуються також в медицині.