Визначення електрохімічного еквівалента міді, безкоштовні курсові, реферати, дипломні роботи
Прилади і приладдя: вольтаметр, джерело живлення, амперметр, реостат, ключ, з'єднувальні дроти, годинник, ваги з важками, наждачний папір, електроплитка.
I. Короткі теоретичні відомості:
Речовини, розчини яких у воді та деяких інших діелектричних рідинах проводить електричний струм, називають електролітами або провідниками другого роду.
З'ясуємо механізм провідності водних розчинів електролітів на прикладі розчину кухонної солі NaCI.
Взаємодія атомів натрію і хлору в молекулі кухонної солі спрощено можна уявити як взаємодію двох іонів: позитивно зарядженого іона Na + і негативно зарядженого іона CI. - (рис.1). Пояснюється це тим, що єдиний валентний електрон у натрію має слабкий зв'язок з атомом. При утворенні молекул NaCI. цей електрон переходить до ...
атому хлору, перетворюючи його в негативний іон CI. -; відповідно до цього молекулу NaCI можна схематично зобразити у вигляді диполя (рис. 2).
При розчиненні кухонної солі у воді молекули NaCI потрапляють в оточення молекул води, яке теж є диполями. В електричному полі, створюваному молекулою NaCI. молекули води орієнтуються так, як показано з рис. 2. При цьому вони розтягують молекулу NaCI настільки, що незначна її струс при відхиленні з іншими молекулами руйнує її. Частина молекул NaCI розпадається - дисоціює на іони Na + і CI. -. Цей процес називається електролітичної дисоціацією. Іони різних знаків при зустрічі можуть знову об'єднатися в нейтральні молекули - рекомбінувати.
При незмінних умовах в розчині встановлюється динамічна рівновага, при якому число молекул, що розпадаються в одиницю часу на іони, дорівнює числу пар іонів, які за той же час знову возз'єднується в нейтральні молекули. Іншими словами, у водних розчинах електролітів завжди є в наявності вільні носії зарядів - позитивно і негативно заряджені іони.
Якщо в посудину з розчином електроліту опустити електроди і включити їх в електричний ланцюг, то негативні іони почнуть рухатися до позитивного електрода - анода, а позитивні до негативного - катода. В результаті встановлюється електричний струм. Оскільки перенесення заряду у водних розчинах чи розплавах електролітів здійснюється іонами, таку провідність називають іонної.
При проходженні струму, наприклад, через розчин мідного купоросу СuSO4 відбувається наступний процес. Позитивні іони Сu ++ при зіткненні з катодом отримують відсутні електрони і виділяються на катоді у вигляді нейтральних атомів. Негативні іони (SO4) - - при зіткненні з анодом віддають зайві електрони. З'явилися на аноді електрони по зовнішньому ланцюзі переходять на катод і там з'єднуються з позитивними іонами. Якщо анод мідний, то нейтралізувати іони SO4 вступають з ними в хімічну реакцію і знову утворюють молекули мідного купоросу: SO4 + Сu СuSO4
В результаті кількість мідного купоросу в розчині залишається незмінним, на катоді виділяється мідь, а мідь з анода, вступаючи в хімічну реакцію з групою SO4. переходить в розчин.
Процес виділення на електродах продуктів розкладання електроліту при проходженні через цей електроліт електричного струму, називається електролізом. Відповідно до першого закону Фарадея, маса виделівщегося на електроді речовини m пропорційна силі струму I і часу його проходження t.
де k-коефіцієнт пропорційності, а It = q заряд, перенесений іонами за час t.
З формули / 1 / видно, що коефіцієнт k чисельно дорівнює масі виділився на електродах речовини при перенесенні іонами заряду, рівного 1 Кулону. Величину k називають електрохімічним еквівалентом даної речовини. Електрохімічний еквівалент виражається в кг / Кл.
Згідно з другим законом Фарадея, електрохімічний еквівалент речовини пропорційний його хімічному еквіваленту.
де М - молярна маса речовини,
С - постійна величина, однакова для всіх елементів.
Ввівши замість коефіцієнта З величину, йому зворотну, другий закон Фарадея можна переписати у вигляді:
де число Фарадея.
Об'єднуючи формули / 1 / і / 3 /, отримаємо:
Якщо маса виділився речовини дорівнює його хімічному еквіваленту, т. Е. / M / = / /, то / F / = / q /. Таким чином, число Фарадея F чисельно дорівнює кількості електрики g, при проходженні якого через електроліт на електроді виділяється кількість речовини, що дорівнює хімічному еквіваленту, F = 9.6484 * 10 4 Кл / моль.
У даній роботі потрібно визначити електрохімічний еквівалент міді і число Фарадея.
II. ОПИС ЕКСПЕРИМЕНТАЛЬНОЇ УСІАНОВКІ.
Для визначення електрохімічних еквівалентів різних речовин користуються так званими вольтметрами. Мідний вольтметр складається зі скляної банки, в яку налито розчин мідного купоросу і занурені дві пластинки з червоної міді, забезпечені клемами для включення їх в ланцюг / см. рис.3 / .Електріческое поле між електродами створюється за допомогою джерела струму / акумулятора, випрямляча і ін. /, сила струму регулюється реостатом R і вимірюється амперметром А. Ланцюг замикається ключем К, час відзначається по годинах.
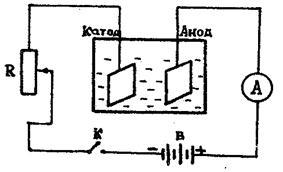
II. Порядок виконання роботи:
1. Зачистіть електроди наждачним папером, промийте струменем води з під крана і просушіть над електроплиткою (електроди повинні бути абсолютно чистими).
2. Визначте масу однієї з платівок m1 на вагах з точністю 0,01 грама.
3. Зберіть схему згідно рис. 3, використовуючи в якості катода пластинку з відомою масою.
4. Заблокуйте ланцюг ключем К і встановіть реостатом R силу струму I.
5. Проведіть процес електролізу в плині часу t (сила струму I і час процесу t задається викладачем).
6. Вийміть катодний пластинку, помийте її струменем води, просушіть її і визначте масу m2.
7. Обчисліть масу m відклався на платівці міді: m = m2 - m1.
8. Підставляючи значення m, I, t в формулу (1), розрахуйте електрохімічний еквівалент міді k.
9. Обчисліть число Фарадея по формулі: знаючи, що М = 63,57 * 10 -3 Кл / моль, а z = 2.
10. Дані вимірювань і обчислень занесіть в таблицю 1.
11. Зробіть висновки.
IV. Контрольні питання:.
1. Що називається електролізом?
2. Що називається ступенем дисоціації, електролітичної дисоціацією, рекомбинацией?
3. Що таке електроліт?
4. Сформулюйте закон Фарадея.
5. Який фізичний зміст електрохімічного еквівалента, числа Фарадея?
6. У якому випадку буде (не буде) зміняться концентрація електроліту в процесі досвіду?
7. Виведіть закон Ома в диференціальній формі для рідин.
Лабораторна робота № 15
ВИЗНАЧЕННЯ ОПОРУ провідників місток Уитстоном
Градуювання термопар і ВИЗНАЧЕННЯ ТЕМПЕРАТУРИ ТІЛА
Поділитися з друзями: