Хімічний каталог сульфаміди
сульфамідів
Сульфамідів (аміди сульфокислот, сульфоніламіди, сульфонаміди), з'єднання загальної формули RSO2 NR "R. Де R-opг. Залишок, R" і R. -H або органічне остатоколо Розрізняють незаміщені RSO2 NH2. монозаміщені RSO2 NHR "і диза-ня сульфамідів RSO2 NR" R. а також дісульфонаміди (ді-сульфоніламіни) RSO2 NR "SO2 R. трісул'фонаміди (три-сульфоніламіни) RSO2 N (SO2 R) 2. Відомі циклічні сульфамідів (сультами)
Назв. вакантних сульфамідів виробляють від назв. відповідних сульфокислот, наприклад СН3 SО2 NН2 -амід метансуль-фокіслоти, або метансульфамід, n-CH3 C6 H4 SO2 N (CH3) 2 - N. N -діметіл-n-толуолсульфамід. Ді-і трісульфон аміди часто називають як похідні амінів, наприклад (CH3 SO2) 2 NH - біс (метилсульфоніл) амін.
Атом S в сульфамідів має тетраедріч. конфігурацію; довжини зв'язків, наприклад, для CH3 SO2 NH2 0,181 нм (С-S), 0,146 нм (S-О), 0,161 нм (S-N), кут CSN 113 °, CSO 106 °. Сульфамідні групи в ароматичних сульфамідів мають отрицат. індукційним і мезомерним ефектами; константи Гаммета s мета 0,55, s пара 0,62.
В ІК спектрах вакантних і монозаміщених сульфамідів присутні типовий. смуги в області 3350-3250 см -1 (вільне володіння групи N H2 і NH, 2 смуги), 1430-1330 см -1 і 1180-1140 см -1 (асиметричні і симетричні валентні коливання групи SO2) і 910-900 см -1 (S-N). У спектрі ПМР для незаміщених і монозаміщених сульфамідів хімічний зсув d 5-8 М.Д. (Група N H2) і 7-11 М.Д. (Група N H).
Більшість сульфамідів-бесцв. кристаллич. речовини, деякі аліфатичні сульфамідів-маслоподібними рідини (див. табл.); помірно розчинний у воді і полярних органічних розчинниках.

Незаміщені і монозаміщені сульфамідів-слабкі кислоти, ді-сульфануламіди-значно сильніші кислоти; останні в водних розчинах лугів утворюють солі, на різні розчинності яких заснована поділ первинних, вторинних і третинних амінів (тест Хінсберга).
Водні розчини мінеральних кислот гідролізують сульфамідів з розривом зв'язку S-N і утворенням відповідних сульфокислот і амінів (у вигляді амонієвих солей); монозаміщені сульфамідів, що містять залишки, з яких легко утворюються карбка-ції, гідролізуються кислотами з розривом зв'язку N-С, наприклад:
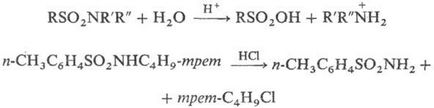
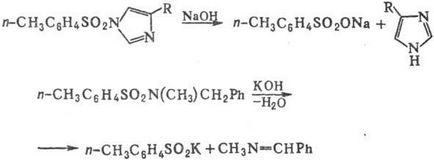
Водні розчини підстав гидролизуют сульфамідів тільки в жорстких умовах або у випадках, коли фрагмент NR "R. -легко йде група; при цьому утворюються вільний аміни і солі сульфокислот; деякі сульфамідів при дії лугів дають солі сульфінових кислот і альдіміни, наприклад:
Більшість сульфамідів стійко до дії відновників і окислювачів. Виняток становлять деякі дізамещен-ні сульфамідів, які при каталітичних гидрировании або при дії LiAlH4. HI, НВг і ін. Піддаються відновить. розщепленню з утворенням амінів і похідних S (II) і S (IV), а також N-алкілдісульфаміди, розщеплення яких при дії LiAlН4 або NaBH4 протікає по зв'язку С-N, наприклад:
Дії окислювачів піддаються лише сульфамідів, що містять залишок азотистого гетероциклу; при цьому розривається зв'язок С-N, наприклад:
.
Під дією H N О2 незаміщені сульфамідів дезамінується, монозаміщені утворюють N-нітрозопохідні (деякі з останніх використовують для отримання діазоалканов):
Взаимод. вакантних сульфамідів з HNO3 призводить до нітрит-амідів: RSO2 NH2 + H N О3. RSO2 NHNO2 + Н2 О.
Ангідриди, хлорангидріди і арилових ефіри карбо-нових кислот ацилуючий незаміщені і монозаміщені сульфамідів з утворенням N-ацильних похідних; при обробці вакантних сульфамідів фосгеном утворюються сульфонілізоціа-нати, наприклад:
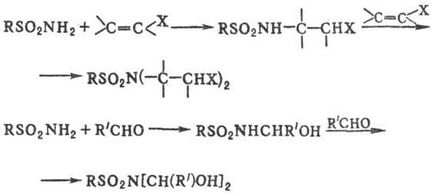
Незаміщені і монозаміщені сульфамідів приєднуються по активир. кратними зв'язками з утворенням N-заміщених сульфамідів; з альдегідами і кетонами утворюються продукти приєднання по зв'язку С = О, які піддаються подальшим перетворенням:
Карбонільні сполуки, що містять електроноакцепторні заступники (наприклад, полігалогеналкільние групи), в при-сут. підстав і дегидратирующих засобів утворюють з незаміщеними сульфамідів реакционноспособниє сульфоніліміни:
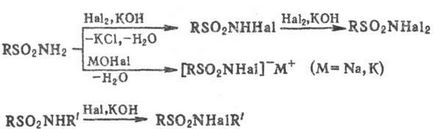
Обробка вакантних і монозаміщених сульфамідів галогенами (Cl2. Вr2) в присутності підстав або розчинами гіпо- галогенітов лужних і щел.-зем. металів призводить до N-галоген- або N. N -дігалогенсульфамідам; солі N-гa-логенсульфамідов широко застосовують в промисловості, медицині, військовій справі (див. Хлораміни), наприклад:
При взаємодія вакантних ароматичних сульфамідів з KOCN або з сечовиною утворюються карбамінової похідні сульфамідів (у вигляді солей), а при взаємодії з РСl5 -тріхлорфосфазо-сульфоніларени, наприклад:
Осн. пром. метод отримання сульфаміди - аммоноліз або амінолізу ангідридів, галогенангидридов і ефірів сульфокислот.
Сульфамідів отримують також окисленням сульфенамід або суль-фінамідов Н2 О2. К2 Сr2 О7. КМnО4 або взаємодія солей сульфінових кислот з N-хлорамінами:
Для отримання дизаміщених сульфамідів використовують пере-дирования, наприклад: +
Незаміщені сульфамідів можуть бути отримані взаємодія деяких диазосоединение з SO2 в присутності NH3; амідування сульфінових кислот гідроксиламіном або сульфокислот ацето-амідом; відновленням сульфонілазідов Н2 або з-С3 Н7 ОН при УФ опроміненні, наприклад:
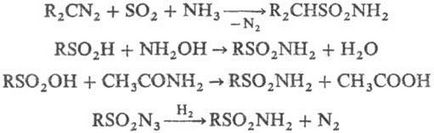
Ароматичні сульфамідів отримують взаємодія ароматичних вуглеводнів з похідними сірчаної кислоти:
b -Сультами отримують по реакції [2 + 2] -ціклопрісоеді-вати до N-сульфоніламінам, g - і d -сультами- циклизацией різні з'єднання, наприклад:
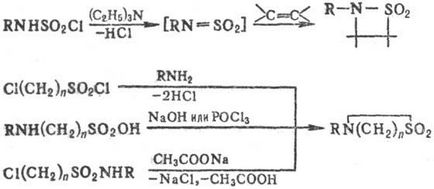
Для синтезу ди-і трісульфамідов використовують суль-фонілірованіе солей сульфамідів хлорангидридами сульфокислот, наприклад:
Сульфамідів-проміжні продукти у виробництві ліків (див. Сульфаніламідні препарати), дезінфікуючих засобів, дегазуючих речовин, барвників, оптичний відбілювачів, пластифікаторів.
Див. Також Бензолсульфаміди, Толуолсул'фаміди.
Література: Загальна органічна хімія, пер. з англ. т. 5, М. 1983, с. 528-35; Methodicum Chimicum, v. 7-Main Group elements and their compounds, pt В, N. Y. 1978, p. 710-14. І.І. Крилов.
Хімічна енциклопедія. Том 4 >> До списку статей