Сульфаміди - хімічна енциклопедія - тлумачні словники і енциклопедії
Сульфамідів (аміди сульфокислот, сульфоніламіди, сульфонаміди), соед. загальної ф-ли RSO2 NRR. де R-opг. залишок, R і R: -H або орг. залишок. Розрізняють незаміщені RSO2 NH2. монозаміщені RSO2 NHR і диза-ня С. RSO2 NRR. а також дісульфонаміди (ді-сульфоніламіни) RSO2 NRSO2 R. трісул'фонаміди (три-сульфоніламіни) RSO2 N (SO2 R) 2. Відомі циклічні С. (сультами)
Назв. вакантних С. виробляють від назв. відповідних сульфокислот, напр. СН3 SО2 NН2 -амід метансуль-фокіслоти, або метансульфамід, n -CH3 C6 H4 SO2 N (CH3) 2 - N. N -діметіл-n -толуолсульфамід. Ді-і трісульфонаміди часто називають як похідні амінів, напр. (CH3 SO2) 2 NH - біс - (метилсульфоніл) амін.
Атом S в С. має тетраедріч. конфігурацію; довжини зв'язків, напр. для CH3 SO2 NH2 0,181 нм (С-S), 0,146 нм (S-О), 0,161 нм (S-N), кут CSN 113 °, CSO 106 °. Сульфамідні групи в ароматичних С. володіють отрицат. індукційним і мезомерним ефектами; константи Гаммета s мета 0,55, s пара 0,62.
В ІК спектрах вакантних і монозаміщених С. присутні типовий. смуги в області 3350-3250 см -1 (своб. групи N H2 і NH, 2 смуги), 1430-1330 см -1 і 1180-1140 см -1 (асиметричні і симетричні валентні коливання групи SO2) і 910-900 см - 1 (S-N). У спектрі ПМР для незаміщених і монозаміщених С. хім. зсув d 5-8 М.Д. (Група N H2) і 7-11 М.Д. (Група N H).
Більшість С.-бесцв. кристаллич. в-ва, нек-риє алифатические С.-маслоподібними рідини (див. табл.); помірно розчин. в воді і полярних орг. р-телеглядачам.

Незаміщені і монозаміщені С.-слабкі к-ти, ді-сульфануламіди-значно сильніші к-ти; останні в водних розчинах лугів утворюють солі, на разл. р-рімості яких брало засновано поділ первинних, вторинних і третинних амінів (тест Хінсберга).
Водні розчини мінер. к-т гидролизуют С. з розривом зв'язку S-N і утворенням відповідних сульфокислот і амінів (у вигляді амонієвих солей); монозаміщені С. містять залишки, з яких брало легко утворюються карбка-ції, гідролізуються к-тами з розривом зв'язку N-С, напр .:
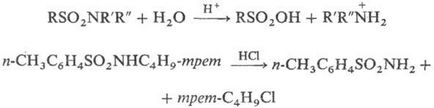
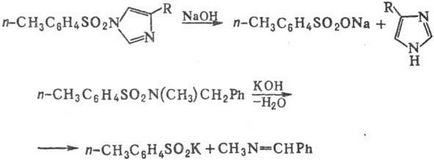
Водні розчини підстав гидролизуют С. тільки в жорстких умовах або у випадках, коли фрагмент NRR: -легко йде група; при цьому утворюються своб. аміни і солі сульфокислот; нек-риє С. при дії лугів дають солі сульфінових к-т і альдіміни, напр .:
Більшість С. стійко до дії відновників і окислювачів. Виняток становлять нек-риє дізамещен-ні С. к-які при каталитич. гидрировании або при дії LiAlH4. HI, НВг і ін. Піддаються відновить. розщепленню з утворенням амінів і похідних S (II) і S (IV), а також N-алкілдісульфаміди, розщеплення яких брало при дії LiА1Н4 або NaBH4 протікає по зв'язку С-N, напр .:
Дії окислювачів піддаються лише С. містять залишок азотистого гетероциклу; при цьому розривається зв'язок С-N, напр .:
.
Під дією H N О2 незаміщені С. дезамінується, монозаміщені утворюють N-нітрозопохідні (нек-риє з останніх використовують для отримання діазоалканов):
Ангідриди, хлорангидріди і арилових ефіри карбо-нових к-т ацилуючий незаміщені і монозаміщені С. з утворенням N-ацильних похідних; при обробці вакантних С. фосгеном утворюються сульфонілізоціа-нати, напр .:
Незаміщені і монозаміщені С. приєднуються по активир. кратними зв'язками з утворенням N-заміщених С .; з альдегідами і кетонами утворюються продукти приєднання по зв'язку С = О, к-які піддаються подальшим перетворенням:
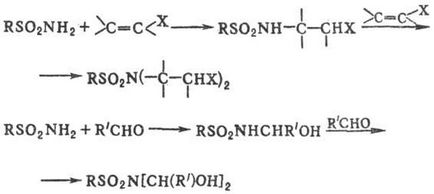
Карбонільні соед. містять електроноакцепторні заступники (напр. полігалогеналкільние групи), в при-сут. підстав і дегидратирующих ср-в утворюють з незаміщеними С. реакционноспособниє сульфоніліміни:
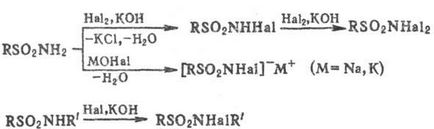
Обробка вакантних і монозаміщених С. галогенами (С12. Вr2) у присутності. підстав або розчинами гіпо- галогенітов лужних і щел.-зем. металів призводить до N-галоген- або N. N -дігалогенсульфамідам; солі N-гa-логенсульфамідов широко застосовують в пром-сти, медицині, військовій справі (див. Хлораміни), напр .:
При взаємодій. вакантних ароматичних С. з KOCN або з сечовиною утворюються карбамінової похідні С. (у вигляді солей), а при взаємодій. з РСl5 -тріхлорфосфазо-сульфоніларени, напр .:
Осн. пром. метод отримання С. - аммоноліз або амінолізу ангідридів, галогенангидридов і ефірів сульфокислот.
С. отримують також окисленням сульфенамід або суль-фінамідов Н2 О2. К2 Сr2 О7. КМnО4 або взаємодій. солей сульфінових к-т з N-хлорамінами:
Для отримання дизаміщених С. використовують пере-дирования, напр. +
Незаміщені С. можуть бути отримані взаємодій. деяких діазосоед. з SO2 в присутності. NH3; амідування сульфінових к-т гідроксиламіном або сульфокислот ацето-амідом; відновленням сульфонілазідов Н2 або з- С3 Н7 ОН при УФ опроміненні, напр .:
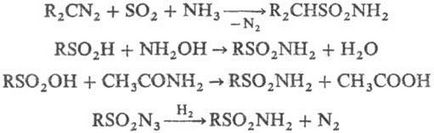
Ароматичні С. отримують взаємодій. ароматич. вуглеводнів з похідними сірчаної к-ти:
b -Сультами отримують по р-ції [2 + 2] -ціклопрісоеді-вати до N-сульфоніламінам, g - і d -сультами- циклизацией разл. соед. напр .:
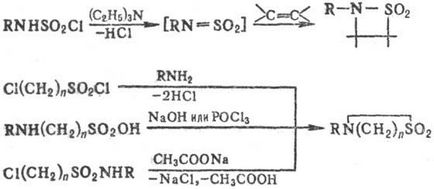
Для синтезу ди-і трісульфамідов використовують суль-фонілірованіе солей С. хлорангидридами сульфокислот, напр .:
С.-промежут. продукти в произове ліків (див. Сульфаніламідні препарати), дезінфікуючих ср-в, дегазирующих в-в, барвників, оптич. відбілювачів, пластифікаторів.
Літ .: Загальна органічна хімія, пер. з англ. т. 5, М. 1983, с. 528-35; Methodicum Chimicum, v. 7-Main Group elements and their compounds, pt В, N. Y. 1978, p. 710-14. І.І. Крилов.