Третинна структура білка
Це просторова укладка α-спіралі або поліпептидного ланцюга в тривимірну структуру (конформацію). За формою третинної структури білки ділять на глобулярні (округлі) і фібрилярні (ниткоподібні).
Зв'язки, що стабілізують третинну структуру утворюються між бічними радикалами амінокислот і їх функціональними групами. Зв'язки можуть бути сильними (ковалентними) і слабкими (полярними і ван-дер-ваальсовими).
Гідрофобні (ван-дер-ваальсові), іонні і водневі зв'язку слабкі, але так як вони багаторазово повторюються в білку, то грають важливу роль у формуванні третинної структури.
При укладанні третинної структури α-спіраль або поліпептидний ланцюг білка прагне прийняти енергетично (термодинамічно) вигідну форму, що характеризується мінімумом вільної енергії. У зв'язку з цим гідрофобні радикали амінокислот, уникаючи води формують ван-дер-ваальсові зв'язку всередині білкової молекули, а гідрофільні групи амінокислот розташовуються ближче до зовнішньої поверхні і пов'язують воду. У центрі білкової глобули практично немає води, а на її поверхні формується гидратная оболонка.
При укладанні третинної структури α-спіраль набуває певну форму в тривимірному просторі (рис. 5).
Мал. 5. Схема просторової
Структури глобулярного білка
Типи зв'язків, які беруть участь у формуванні третинної структури білка (рис. 6).
- гідрофобна зв'язок (ван-дер-ваальсова) - утворюється між гідрофобними (неполярними) радикалами амінокислот;
- водневі зв'язку - утворюються між полярними незарядженими радикалами амінокислот;
- іонні або електростатичні зв'язку - утворюються між полярними зарядженими радикалами амінокислот.
Сильні зв'язку (ковалентні).
- дисульфідний зв'язок - утворюється між двома молекулами цистеїну
- псевдопептідная (ложнопептідная) зв'язок - утворюється між карбоксильною групою радикала однієї амінокислоти і аміногрупою радикала іншої амінокислоти;
- складно-ефірна зв'язок - утворюється між гідроксильною групою серину або треоніну і карбоксильною групою радикалів глутамінової та аспарагінової кислот.
В останнє десятиліття вчені відкрили, що в клітці є спеціалізовані білки і білки-ферменти, які регулюють процес згортання новосинтезованих поліпептидних ланцюгів в правильну нативную третинну структуру. До них відносяться:
- фермент пептділ-пролив-цис / транс-ізомерази - призводить до утворення цис-конформації пептидного зв'язку, утвореної атомом азоту пролина, що викликає поворот поліпептидного ланцюга на 180 о (на даній ділянці поліпептидного ланцюга регулярність α-спіралі порушена);
- фермент протеіндісульфідізомераза - каталізує розщеплення неправильно утворених дисульфідних зв'язків і формує нові S-S-зв'язку, характерні для нативного білка.
- шаперони і шапероніну - це каталитически неактивні білки (відкрив Л.Елліс) - «сімейство білків», допомагають правильній Нековалентні збірці тривимірної білкової конформації і перешкоджають формуванню функціонально неактивних білкових структур. Синтез шаперонов різко посилюється при стресовому температурному впливі, тому їх називають «білки теплового шоку». Шаперони утримують новосинтезовані поліпептидний ланцюг на рибосомах в розгорнутому стані, а шапероніну забезпечують умови для утворення єдиної правильної третинної структури білка.
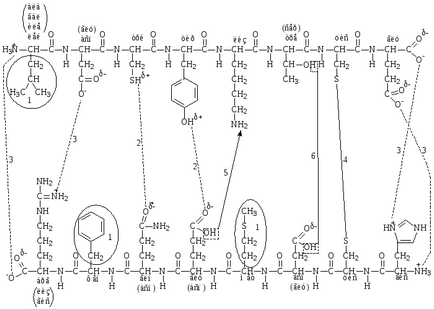
Мал. 6. Зв'язки, які беруть участь у формуванні третинної структури білка