Тема №3 «кінетика хімічних реакцій»
Активні молекули і енергія активації. Кінетична класифікація хімічних процесів.
Швидкість гомогенної хімічної реакції і методи її регулювання (залежність від концентрації, тиску). Закон діючих мас. Коливальні реакції.
Залежність швидкості реакції від температури. Правило Вант-Гоффа. Рівняння Арреніуса.
Залежність швидкості реакції від каталізатора. Каталозі. Гомогенний і гетерогенний каталіз. Механізм дії каталізаторів. Каталізатори і каталітичні системи.
Умова хімічної рівноваги. Особливості кінетики гетерогенних реакцій. Вплив концентрації, тиску і температури на швидкість гетерогенних реакцій. Гетерогенні рівноваги.
Фазовий рівновагу. Поняття фази. Компоненти залежні і незалежні. Правило фаз Гіббса-Коновалова. Ступінь свободи і варіантність системи.
Всі хімічні процеси, які спостерігаються в природі і здійснювані людиною в його практичній діяльності, протікають у часі з певними швидкостями. Напрямок та глибина хімічних перетворень диктується законами термодинаміки. Однак термодинамічне розгляд хімічних процесів не дає відповіді на питання про те, з якою швидкістю і через які проміжні стадії система перейшла з початкового стану в кінцеве. Час протікання хімічної реакції є предметом розгляду хімічної кінетики.
Хімічна кінетика разом з термодинамікою є теоретичною основою хімічної технології, тому що дозволяє інтенсифікувати і оптимізувати промислово важливі реакції.
Принципова можливість протікання хімічної реакції ще не означає, що вона йде насправді. Класичним прикладом може служити окислення органічних речовин, яке термодинамічно можливо навіть при низьких температурах. Якби ці процеси відбувалися з помітною швидкістю в звичайних умовах навколишнього середовища, то був би неможливий сам факт існування живих організмів.
Наприклад, термодинамічний розрахунок показує, що водень і хлор при стандартних умовах повинні самовільно вступати в реакцію, яка призведе до утворення хлороводню. Насправді суміш цих газів може зберігатися в темряві дуже довго і ніяких ознак хімічного взаємодії ми не виявимо. Якщо цю суміш висвітлити ультрафіолетом, реакція відбудеться миттєво і повністю.
Ще приклад, термодинамічна ймовірність реакції окислення водню до води:
Н2 + ½ О2 = Н2О (ж),
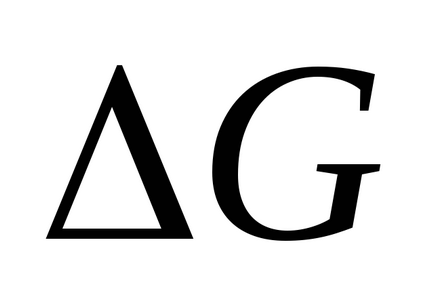
значно вище, ніж вірогідність реакції нейтралізації з утворенням води:
Н ++ ОН- = Н2О (ж),
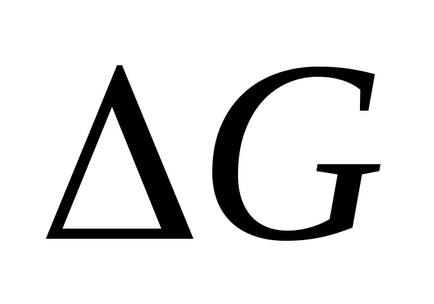
У той же час перша реакція в звичайних умовах без каталізатора практично не йде, а друга протікає практично миттєво.
Хімічна кінетика - це розділ хімії, який вивчає механізм та швидкості протікання хімічних процесів.
Питання 1. Активні молекули і енергія активації
Оскільки хімічна реакція - це процес, при якому відбувається розрив існуючих хімічних зв'язків і утворення нових. Те для здійснення такого процесу необхідно:
Зіткнення реагують частинок (атомів, молекул, іонів);
Наявність у цих частинок достатнього запасу енергії;
Оптимальне розташування частинок щодо один одного в просторі.
Зіткнення двох і більше частинок, що володіють досить великою енергією, дозволяє подолати взаємне відштовхування електронів і забезпечити необхідну для взаємодії ступінь контакту. При цьому відбувається хімічна реакція.
Швидкість хімічної реакції визначається числом зіткнень (елементарних актів реакції), що призводять до хімічного перетворення в одиниці об'єму в одиницю часу.
Однак, не всяке зіткнення призводить до хімічної взаємодії молекул. Давайте поміркуємо. 1 моль будь-якого газу займає об'єм при н.у. 22,4 л, якому містяться 6,02. 10 23 молекул. Таким чином, в 1 см 3 газу міститься

Т.ч. швидкість реакції визначається не числом загальних зіткнень в одиницю часу, а числом зіткнень активних молекул. Активні молекули - це молекули, що володіють підвищеним запасом енергії в порівнянні з середньою енергією молекул тих же речовин. Різниця між запасом енергією активних молекул і середньою енергією молекул цього виду в даних умовах називається енергією активації. Т.ч. енергія активації Еакт. (Дж / моль) являє собою ту кількість енергії, яке потрібно повідомити молекулі з середньою по запасу енергією, щоб зробити цю молекулу активної для реакції.
Теоретичні розрахунки Максвела і Больцмана (1880) показали, що при деякій температурі молекули газу по швидкості їх руху (а, отже, по кінетичної енергії) розподіляються певним чином, причому розподіл не змінюється в часі, незважаючи на те, що кожна окрема молекула безупинно змінює свою швидкість (закон розподілу Максвела-Больцмана).
Згідно з цим законом, завжди існують молекули з високою енергією, достатньою для подолання енергетичного бар'єра.
На рис.1. Т1, Т2, Т3- три різних температури; Е енергія активації, а заштрихована площа характеризує число активних молекул. З збільшення температури крива розподілу зміщується вправо і суттєво збільшується частка активних молекул, і швидкість хімічної реакції також зростає.
Механізм протікання хімічної реакції можна представити графічно, якщо по осі ординат відкласти енергію даної системи, а по осі абсцис - хід реакції (рис.2).
Якщо пряма реакція (тобто перехід зі стану I у стан II) є екзотермічної, то загальний запас енергії продуктів реакції менше, ніж у вихідних речовин, і система в результаті цієї реакції переходить на більш низький енергетичний рівень. Різниця рівнів I і II дорівнює тепловому ефекту реакції

Активація молекул може відбуватися не тільки за рахунок підвищення температури, але і під дією променевої енергії, електричного розряду, ультразвукових коливань, іонізуючих випромінювань.