Швидкість хімічної реакції
Говорити про здійсненності процесу можна по зміні енергії Гібсса системи. Але дана величина не відображає справжню можливість протікання реакції, її швидкість і механізм.
Для повноцінного уявлення хімічної реакції, треба мати знання про те, які існують часові закономірності при її здійсненні, тобто швидкість хімічної реакції і її детальний механізм. Швидкість і механізм реакції вивчає хімічна кінетика - наука про хімічний процесі.
З точки зору хімічної кінетики, реакції можна класифікувати на прості і складні.
Прості реакції - процеси, що протікають без утворення проміжних сполук. За кількістю частинок, які беруть у ній участь, вони діляться на мономолекулярні, бімолекулярні, тримолекулярного. Зіткнення більшого ніж 3 числа частинок малоймовірно, тому тримолекулярного реакції досить рідкісні, а четирехмолекулярние - невідомі. Складні реакції - процеси, що складаються з декількох елементарних реакцій.
Будь-який процес протікає з властивою йому швидкістю, яку можна визначити по змінам, що відбуваються за якийсь відрізок часу. Середню швидкість хімічної реакції виражають зміною кількості речовини n витраченого або отриманого речовини в одиниці об'єму V за одиницю часу t.
Якщо речовина витрачається, то ставимо знак «-», якщо накопичується - «+»
При постійному обсязі:
Одиниця виміру швидкості реакції моль / л · с
В цілому, υ - величина постійна і не залежить від того, за яким беруть участь в реакції речовиною, ми стежимо.
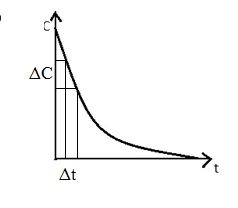
Залежність концентрації реагенту або продукту від часу протікання реакції представляють у вигляді кінетичної кривої. яка має вигляд:
Обчислювати υ з експериментальних даних зручніше, якщо зазначені вище вираження перетворити в такий вираз:
υ = - ΔC / Δt [моль / л · с]
Закон діючих мас. Порядок і константа швидкості реакції
Одна з формулювань закону діючих мас звучить наступним чином: Швидкість елементарної гомогенної хімічної реакції прямо пропорційна добутку концентрацій реагентів.
Якщо досліджуваний процес представити у вигляді:
а А + b В = продукти
то швидкість хімічної реакції можна виразити кінетичним рівнянням:
а і b - стехіометричні коефіцієнти простої реакції,
k - константа швидкості реакції.
Хімічний сенс величини k - це швидкість реакції при одиничних концентраціях. Тобто, якщо концентрації речовин А і В рівні 1, то υ = k.
Треба враховувати, що в складних хімічних процесах коефіцієнти а і b не збігаються зі стехиометрическими.
Закон діючих мас виконується при дотриманні ряду умов:
- Реакція активується термічно, тобто енергією теплового руху молекул.
- Концентрація реагентів розподілена рівномірно.
- Властивості і умови середовища в ході процесу не змінюються.
- Властивості середовища не повинні впливати на k.
До складних процесів закон дії мас застосувати не можна. Це можна пояснити тим, що складний процес складається з декількох елементарних стадій, і його швидкість буде визначатися не сумарною швидкістю всіх стадій, лише однієї найповільнішої стадією, которя називається лімітуючої.
Кожна реакція має свій порядок. Визначають приватний (парціальний) порядок по реагенту і загальний (повний) порядок. Наприклад, в вираженні швидкості хімічної реакції для процесу
а А + b В = продукти
a - порядок по реагенту А
Для простих процесів порядок реакції вказує на кількість реагуючих частинок (збігається з стехиометрическими коефіцієнтами) і приймає цілочисельні значення. Для складних процесів порядок реакції не збігається зі стехиометрическими коефіцієнтами і може бути будь-яким.
Визначимо фактори, що впливають на швидкість хімічної реакції υ.
Залежність швидкості реакції від концентрації реагуючих речовин
Очевидно, що зі збільшенням концентрацій реагуючих речовин, υ збільшується, тому що збільшується число зіткнень між що беруть участь в хімічному процесі речовинами. Причому, важливо враховувати порядок реакції: якщо це n = 1 по деякому реагенту, то її швидкість прямо пропорційна концентрації цієї речовини. Якщо за будь-яких реагенту n = 2. то подвоєння його концентрації призведе до зростання швидкості реакції в 2 + 2 = 4 рази, а збільшення концентрації в 3 рази прискорить реакцію в 3 2 = 9 разів.
Залежність швидкості реакції від тиску
визначається рівнянням Клапейрона - Менделєєва. яке пов'язує концентрацію і тиск:
Таким чином, зміна концентрації в системі, а отже і швидкості реакції має пряму залежність від зміни тиску. Ця залежність актуальна в першу чергу для процесів, що йдуть за участю газів. Наприклад, для реакції першого порядку, збільшення тиску в 2 рази викличе зростання концентрації речовини в 2 рази, що неодмінно змінить υ - вона стане в 2 рази більше.
Завісімостьскорості реакцііот площі поверхні
стосується гетерогенних реакцій. Речовини реагують швидше, якщо площа поверхні, на якій може відбуватися взаємодія речовин більше. Розчиняючи речовину, ми зменшуємо його розміри до розмірів молекули, збільшуючи тим самим площу поверхні. Тому хімічні процеси між речовинами, що знаходяться в розчиненому, рідкому або газоподібному стані мають більшу швидкість, ніж взаємодії між твердими речовинами.Завісімостьскорості реакцііот природи речовини.
Має велике значення будова електронної оболонки атома, тип хімічного зв'язку і її міцність в молекулах, структура речовини, міцність його кристалічної решітки. Відомо, що натрій буде активніше взаємодіяти з водою, ніж, наприклад, олово. Тому і швидкість взаємодії натрію з водою вище швидкості взаємодії олова з водою.Залежність швидкості реакції від температури
визначається правилом Вант-Гоффа і рівнянням Арреніуса. Підвищуючи температуру, ми повідомляємо молекулам додаткову енергію (збільшуючи, тим самим, енергію активації), яка сприяє протіканню реакції. Сванте Арреніус в 1889 році, вивчаючи залежність υ від температури, встановив, що більшість хімічних процесів підкоряються рівнянню:
де k - константа швидкості реакції
Еа-енергія активації - мінімальна (критична) енергія, необхідна для здійснення реакції, одиниця виміру Дж / моль
Т - абсолютна температура
R - газова постійна, R = 8,314 Дж / моль · град
A - предекспоненціальний множник (частотний фактор), одиниця виміру збігається з k. Ця константа висловлює ймовірність того, що при зіткненні молекули будуть орієнтовані так, щоб взаємодія була можливо.
Часто буває, що відома константа швидкості при одній температурі Т1. а потрібно знайти k при деякій іншій температурі Т2. Це легко зробити, якщо взяти логарифм рівняння Арреніуса при Т1 і Т2:
Віднімаючи друга рівність з першого, отримуємо:
При визначенні швидкості хімічної реакції, також можна використовувати рівняння Арреніуса (в разі, якщо υ описується статечним рівнянням):
Якщо прийняти, що концентрації речовин А і В постійні і прологаріфміровать цей вислів, то отримаємо наступне:
Також зручно користуватися емпіричним правилом, яке сформулював Якоб Вант-Гофф. збільшення температури на кожні 10 градусів, призводить до зростання швидкості реакції в 2 - 4 рази. Правило має математичний вираз:
γ - температурний коефіцієнт реакції, значення якого лежать в інтервалі від 2 до 4.
υT1 / υT2 = 3 2 = 9. Це означає, що υ зросла в 9 разів.
Залежність швидкості реакції від присутності каталізатора
Каталіз - це будь-яка зміна швидкості реакції під дією каталізатора. Він може бути позитивним і негативним. Суть каталізу - генерування активного субстрату або реагенту за участю каталізаторів.
Каталізатор є речовина, яке селективно прискорює хімічну реакцію, вступаючи при цьому в проміжну стадію, але регеніріруясь до її кінця (до моменту утворення кінцевих продуктів). Наприклад, в біохімічної середовищі в якості каталізаторів виступають ферменти.
Якщо така речовина уповільнює хімічну реакцію, то воно називається інгібітором.
Вплив каталізатора на швидкість реакції грунтується на тому, що він змінює енергію активації Е а чи А. Зниження енергії активації під дією каталізатора схематично представлено на малюнку нижче:
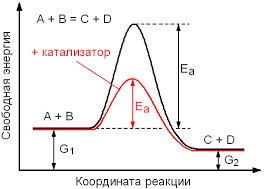
Видно, що речовинам А і В потрібна велика кількість енергії, щоб утворити кінцеві продукти. Але в присутності каталізатора для отримання кінцевих продуктів потрібно набагато менше енергії, тому що йде зниження повної енергії активації, і тим самим, збільшення швидкості реакції. Звертаю вашу увагу на те, що енергії як початкових, так і кінцевих речовин залишаються однаковими в обох реакціях.