Класифікація хімічних реакцій в неорганічної та органічної хімії, ЄДІ з хімії
Класифікація хімічних реакцій в неорганічної та органічної хімії
Хімічні реакції, або хімічні явища, - це процеси, в результаті яких з одних речовин утворюються інші, що відрізняються від них за складом і (або) будовою.
При хімічних реакціях обов'язково відбувається зміна речовин, при якому рвуться старі і утворюються нові зв'язки між атомами.
Хімічні реакції слід відрізняти від ядерних реакцій. В результаті хімічної реакції загальне число атомів кожного хімічного елемента і його ізотопний склад не змінюються. Інша річ ядерні реакції - процеси перетворення атомних ядер в результаті їх взаємодії з іншими ядрами або елементарними частинками, наприклад, перетворення алюмінію в магній:
Класифікація хімічних реакцій багатопланова, тобто в її основу можуть бути покладені різні ознаки. Але під будь-який з таких ознак можуть бути віднесені реакції як між неорганічними, так і між органічними речовинами.
Розглянемо класифікацію хімічних реакцій за різними ознаками.
Класифікація хімічних реакцій за кількістю і складом реагуючих речовин. Реакції, що відбуваються без зміни складу речовини
У неорганічної хімії до таких реакцій можна віднести процеси отримання аллотропних модифікацій одного хімічного елемента, наприклад:
У органічної хімії до цього типу реакцій можуть бути віднесені реакції ізомеризації, які йдуть без зміни не тільки якісного, але й кількісного складу молекул речовин, наприклад:
1. Ізомеризація алканів.
Реакція ізомеризації алканів має велике практичне значення, тому що вуглеводні изостроения мають нижчу здатність до детонації.
2. Ізомеризація алкенов.
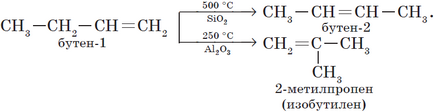
3. Ізомеризація алкинов (реакція А. Е. Фаворського).
4. Ізомеризація галогеналканов (А. Е. Фаворський).
5. Ізомеризація цианата амонію при нагріванні.
Вперше сечовина була синтезована Ф. Велером в 1882 р изомеризацией цианата амонію при нагріванні.
Реакції, що відбуваються зі зміною складу речовини
Можна виділити чотири типи таких реакцій: сполучення, розкладу, заміщення та обміну.
1. Реакції з'єднання - це такі реакції, при яких з двох і більше речовин утворюється одна складна речовина.
У неорганічної хімії все різноманіття реакцій з'єднання можна розглянути на прикладі реакцій отримання сірчаної кислоти з сірки:
1) отримання оксиду сірки (IV):
$ S + O_2 = SO_2 $ - з двох простих речовин утворюється одне складне;
2) отримання оксиду сірки (VI):
$ 2SO_2 + O_2↖2SO_3 $ - з простого і складного речовин утворюється одне складне;
3) отримання сірчаної кислоти:
$ SO_3 + H_2O = H_2SO_4 $ - з двох складних речовин утворюється одне складне.
Прикладом реакції з'єднання, при якій одне складне речовина утворюється з більш ніж двох вихідних, може служити заключна стадія отримання азотної кислоти:
У органічної хімії реакції з'єднання прийнято називати реакціями приєднання. Все різноманіття таких реакцій можна розглянути на прикладі блоку реакцій, що характеризують властивості ненасичених речовин, наприклад етилену:
1) реакція гідрування - приєднання водню:
2) реакція гідратації - приєднання води:
3) реакція полімеризації:
2. Реакції розкладання - це такі реакції, при яких з одного складного речовини утворюється кілька нових речовин.
У неорганічної хімії все різноманіття таких реакцій можна розглянути на прикладі блоку реакцій отримання кисню лабораторними методами:
1) розкладання оксиду ртуті (II):
$ 2HgO↖2Hg + O_2 ↑ $ - з одного складного речовини утворюються два простих;
2) розкладання нітрату калію:
$ 2KNO_3↖2KNO_2 + O_2 ↑ $ - з одного складного речовини утворюються одне просте і одне складне;
3) розкладання перманганату калію:
$ 2KMnO_4↖K_2MnO_4 + MnO_2 + O_2 ↑ $ - з одного складного речовини утворюються два складних і одне просте, тобто три нових речовини.
У органічної хімії реакції розкладання можна розглянути на прикладі блоку реакцій отримання етилену в лабораторії і промисловості:
1) дегідратація (відщеплення води) етанолу:
2) реакція дегідрування (відщеплення водню) етану:
3) реакція крекінгу (розщеплення) пропану:
3. Реакції заміщення - це такі реакції, в результаті яких атоми простої речовини заміщають атоми будь-якого елементу в складному речовині.
У неорганічної хімії прикладом таких процесів може служити блок реакцій, що характеризують властивості, наприклад, металів:
1) взаємодія лужних і лужноземельних металів з водою:
2) взаємодія металів з кислотами в розчині:
3) взаємодія металів з солями в розчині:
Предметом вивчення органічної хімії є не прості речовини, а тільки з'єднання. Тому як приклад реакції заміщення наведемо найбільш характерна властивість граничних з'єднань, зокрема метану, - здатність його атомів водню заміщатися на атоми галогену:
Інший приклад - бромування ароматичного сполуки (бензолу, толуолу, аніліну):
Звернемо увагу на особливість реакцій заміщення у органічних речовин: в результаті таких реакцій утворюються не просте і складне речовини, як в неорганічної хімії, а два складних речовини.
У органічної хімії до реакцій заміщення відносять і деякі реакції між двома складними речовинами, наприклад, нітрування бензолу:
Вона формально є реакцією обміну. Те, що це реакція заміщення, стає зрозумілим тільки при розгляді її механізму.
4. Реакції обміну - це такі реакції, при яких два складних речовини обмінюються своїми складовими частинами.
Ці реакції характеризують властивості електролітів і в розчинах протікають по правилу Бертолле, тобто тільки в тому випадку, якщо в результаті утворюється осад, газ або малодиссоциирующие речовина (наприклад, $ Н_2О $).
У неорганічної хімії це може бути блок реакцій, що характеризують, наприклад, властивості лугів:
1) реакція нейтралізації, що йде з утворенням солі і води:
або в іонному вигляді:
2) реакція між лугом і сіллю, що йде з утворенням газу:
або в іонному вигляді:
3) реакція між лугом і сіллю, що йде з утворенням осаду:
або в іонному вигляді:
У органічної хімії можна розглянути блок реакцій, що характеризують, наприклад, властивості оцтової кислоти:
1) реакція, що йде з утворенням слабкого електроліту - $ H_2O $:
2) реакція, що йде з утворенням газу:
3) реакція, що йде з утворенням осаду:
Класифікація хімічних реакцій за зміною ступенів окислення хімічних елементів, що утворюють речовини
Реакції, що відбуваються зі зміною ступенів окислення елементів, або окислювально-відновні реакції.
До них відноситься безліч реакцій, в тому числі всі реакції заміщення, а також ті реакції з'єднання і розкладання, в яких бере участь хоча б одне просте речовина, наприклад:
Як ви пам'ятаєте, складні окислювально-відновні реакції складаються за допомогою методу електронного балансу:
У органічної хімії яскравим прикладом окислювально-відновних реакцій можуть служити властивості альдегідів:
1. Альдегіди відновлюються до відповідних спирти:
2. Альдегіди окислюються до відповідних кислоти:
Реакції, що відбуваються без зміни ступенів окислення хімічних елементів.
До них, наприклад, відносяться всі реакції іонного обміну, а також:
- багато реакції з'єднання:
- багато реакції розкладання:
Класифікація хімічних реакцій за тепловим ефектом
За тепловим ефектом реакції ділять на екзотермічні і ендотермічні.
Ці реакції протікають з виділенням енергії.
До них відносяться майже всі реакції з'єднання. Рідкісний виняток становлять ендотермічні реакції синтезу оксиду азоту (II) з азоту і кисню і реакція газоподібного водню з твердим йодом:
$ N_2 + O_2 = 2NO - Q $,
Екзотермічні реакції, які протікають з виділенням світла, відносять до реакцій горіння, наприклад:
Гідрування етилену - приклад екзотермічної реакції:
Вона йде при кімнатній температурі.
Ендотермічна реакції
Ці реакції протікають з поглинанням енергії.
Очевидно, що до них відносяться майже всі реакції розкладання, наприклад:
а) випал вапняку:
б) крекінг бутану:
Кількість виділеної або поглиненої в результаті реакції енергії називають тепловим ефектом реакції. а рівняння хімічної реакції із зазначенням цього ефекту називають термохимическим рівнянням. наприклад:
Класифікація хімічних реакцій за агрегатним станом реагуючих речовин (фазовим складом)
Це реакції, в яких реагуючі речовини і продукти реакції перебувають в різних агрегатних станах (в різних фазах):
Це реакції, в яких реагуючі речовини і продукти реакції перебувають в одному агрегатному стані (в одній фазі):
Класифікація хімічних реакцій за участі каталізатора
Некаталітичні реакції йдуть без участі каталізатора:
Каталітичні реакції йдуть за участю каталізатора:
Так як всі біологічні реакції, які відбуваються в клітинах живих організмів, йдуть за участю особливих біологічних каталізаторів білкової природи - ферментів, всі вони відносяться до каталітичних або, точніше, ферментативним.
Слід зазначити, що більш $ 70% $ хімічних виробництв використовують каталізатори.
Класифікація хімічних реакцій за направленням
Необоротні реакції протікають в даних умовах тільки в од ном напрямку.
До них можна віднести всі реакції обміну, що супроводжуються утворенням осаду, газу або малодиссоциирующие речовини (води), і все реакції горіння.
Оборотні реакції в даних умовах протікають одночасно в двох протилежних напрямках.
Таких реакцій переважна більшість.
У органічної хімії ознака оборотності відображають назви-антоніми процесів:
- гедрірованіе - дегидрирование;
- гідратація - дегідратація;
- полімеризація - деполимеризация.
Оборотні все реакції етерифікації (протилежний процес, як ви знаєте, носить назву гідролізу) і гідролізу білків, складних ефірів, вуглеводів, полинуклеотидов. Оборотність лежить в основі найважливішого процесу в живому організмі - обміну речовин.