Реакції електрофільного приєднання, електрофільного заміщення
Електрофільні реакції. Механізм електрофільних реакцій полягає в атаці електрофени на нуклеофільний реакційних-ний центр (N-центр). В якості такого центру в молекулі суб-страта найчастіше виступає кратна зв'язок (sp- або -гібрідізованние атоми вуглецю), ароматичне (бензольне) ядро, по-кільки в цих випадках є область підвищеної -Електронна щільності.
Атакуюча частинка - електрофіл - може утворитися в результаті яких гетеролиза зв'язку, наприклад:. або поляризації ковалентного зв'язку поблизу N-центру. У послід-нього випадку утворюється так званий індукований (або на-ведений) диполь:.
Реакції електрофільного приєднання (АЕ). Розрізняють два ос-новних механізму реакцій електрофільного приєднання.
1. -Комплексний механізм. Такий шлях реакції характерний перш за все при приєднанні неполярних і малополярних речовин до з'єднань, що містить подвійну вуглець вуглець-ву зв'язок. Розглянемо механізм реакції на прикладі приєднання-нення брому. Збагачений електронами реакційний центр по-лярізует молекулу брому, надаючи їй електрофільні властивості; утворюється активний комплекс интермедиат - циклічний бромоніевий іон. Стадія I є лімітуючої стадією процес-са. Далі швидко відбувається атака нуклеофільної частки з боку, протилежного (так зване антіпрісоеді-ня), що пояснюється просторовими труднощами через досить великих розмірів атома брому (стадія II). Для ре-акції характерний кислотний каталіз, в тому числі каталіз кисло-тами Льюїса:
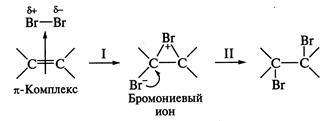
2. карбкатион механізм. Такий шлях реакції реалізується при приєднанні полярних частинок (HHal, і ін.); Ліміти-рующей стадією реакції є протонирование подвійний свя-зи (стадія I) з утворенням карбкатиона, з подальшою шви-рій атакою нуклеофільної частки () на електронодефіцітний атом вуглецю (стадія II); наприклад, приєднання бромоводорода:
Реакція нестереоспеціфічна. При приєднанні галогеноводородов їх реакційна здатність (і швидкість реакції) сни-жается в ряду: HI, НВг, НС1, HF.
Реакції гідратації (реакції приєднання води) йдуть в ус-ловиях кислотного каталізу. Кислоти утворюють при іонізації іони, що володіють досить слабкими нуклеофільними властивості-ми:. Утворений при протонировании карбкатион атакується нуклеофілом - молекулою води - з освітньої-ням алкілоксоніевого іона. Останній стабілізується шляхом відщеплення протона в результаті гетеролиза зв'язку О-Н, від-ходить «повернення каталізатора», реакція оборотна. Зворотній реак-ція - катализируемая кислотами дегідратація спиртів:
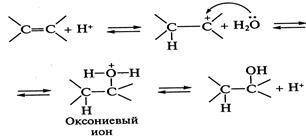
Освіта алкілоксоніевого іона є лімітуючої стадією реакції. Крім того, реакція може протікати по π - комплексному механізму, при якому на першій стадії утворюється активоване комплекс:
на який і спрямована атака нуклеофіла - молекули води.
Розглянемо два можливих шляхи приєднання бромоводорода до пропеніл:
На напрям атаки електрофени впливають насамперед два чинники.
1.Перераспределеніе електронної щільності -Зв'язку слідом-ствие позитивного індуктивного ефекту оточення (Метален-ної групи):
Електрофіл переважно атакує атом вуглецю з підвищеними-шенной електронної щільністю, тобто реакція буде протікати по першому шляху.
2.Устойчівость утворюються карбкатион. Утворений в результаті атаки по першому шляху вторічний.карбкатіон є більш стійким, ніж первинний - продукт атаки електрофени іншим шляхом. Ще більшою стійкістю
мають третинні карбкатион.
Отже, вплив обох факторів призводить до освітньої-ня 2-бромпропана (перший шлях). Коротко цей механізм визначається правилом В.В. Марковникова.
При приєднанні до несиметричним алкенам полярних реагентів типу НХ електрофільне частка протон (Н +) приєднується до більш гідрогенізовані атому вуглецю, а аніон Х - - до менш гідрогенізовані атому вуглецю при подвійному зв'язку.
На швидкість реакції впливає будова субстра-та, т. Е. Найближче оточення реакційного центру. Так, електронодонорні заступники збільшують швидкість реакції, обліг-чаю приєднання (підвищують електронну щільність всередині реакційного центру), а електроноакцепторні заступники сни-жають швидкість реакції, ускладнюючи приєднання електрофени. Зниження швидкості реакції відбувається в ряду:
Сполучення збільшує реакційну здатність подвійний вуглець-вуглецевого зв'язку щодо електрофілов і відпо-відно підвищує швидкість реакцій. Процес протікає через послідовні стадії, пов'язані з утворенням карбкатиона, так як він стабілізується за рахунок делокалізації заряду:
Протонирование йде іншим шляхом, оскільки в цьому слу-чаї утворюється сполучена система аллільного типу за рахунок вза-імодействія електронодефіцітного атома вуглецю з - електронами подвійного зв'язку:
Карбкатион аллільного типу є активним електрофільним алкілуючі агенти в живих організмах. Делокалізація електронної щільності в результаті освіти пов'язаною системи зумовлює два можливих напрямки атаки нуклеофілом:
Таким чином, в результаті реакції утворюється суміш продук-тов 1,2-приєднання (другий шлях) і 1,4-приєднання (пер-вий шлях), склад якої залежить від умов реакцій.
З'єднання з потрійним зв'язком, що містять атоми вуглецю в стані гібридизації, в цілому менш реакційноздатні в реакціях. Утворений в результаті протонування карб-катіон - вінілкатіон - є малостійким. На стадії депротонування оксоніевого іона в результаті зсуву таутомерного рівноваги (кето-енольна таутомерія) утворюються оксосполук (кетони):
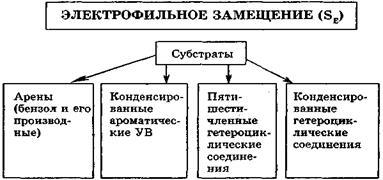
Реакції електрофільного заміщення (SE). Для ароматичних сполук бензольного рада, конденсованих і гетероцік-вих ароматичних сполук характерні реакції елект-рофільного заміщення.
Особливістю реакцій SE є те, що атакуючий реагент - електрофіл - утворюється на першій стадії реакції в присутності кислот Льюїса (реакції галогенування, алкілування і ацилювання по Фриделю-Крафтс) або в умовах кислотного каталізу (алкілування алкенами і спиртами, нітрування), наприклад:
Новоутворена електрофільне частка атакує нуклеофільний центр - бензольне ядро. В результаті атаки утворюється нестійка структура (-комплекс) з порушеною системою кругового сполучення. Ця стадія є лімітуючої (стадія I). Стабілізація структури відбувається шляхом відщеплення про-тону від -комплексу з утворенням кінцевого продукту.
За цим механізмом (SЕ) з вище переліченими суб-стратами протікають реакції нітрування, сульфування, алкілування, галогенування, ацилювання.
1. Освіта електрофільної частки - іона нитрония (NO2 +):
2. Освіта π-комплексу:
бензол π-комплекс
3. Освіта # 963; -комплексу
π - комплекс # 963; - комплекс
В # 963; -комплекс один вуглець переходить в стан sp 3 гібридизації, ароматичность порушується, комплекс нестійкий і стабілізація його відбувається шляхом викидами-са Н +.
4. Освіта нитробензола:
5. Н + + НSO → Н2 SO4 (регенерація каталізатора)
Вплив замісників на реакційну здатність в ході SE
Однозаміщені бензолу ізомерів не мають, але якщо в кільці з'являються заступники, то симетрія кільця нару-шена і за допомогою квантово-механічних розрахунків вдалося встановити, що всі заступники діляться на дві групи:
I роду Електродонорние (ЕД) - за винятком галогенів. Вони підвищують електронну щільність кільця, особливо, в орто- і пара-положеннях. До них відносяться: ОН; -NH2. -CH3. . -О-R; -NHR; Cl; Br; I. Заступники I роду направляють знову прибувають групи в орто- і пара-положення
II роду електроноакцепторні (ЕА); вони знижують електронну щільність кільця, особливо, в орто- і пара-положеннях. До них відносяться заступники, які мають в своєму складі подвійну зв'язок, тому що при цьому відбувається π-π-спряження:. . -SO3 H, -NО2; -С≡Н; Заступники II роду направляють прибувають групи в мета-положення
Таким чином, як і в разі реакцій на реакційну здатність і ско-кість реакції впливає структура субстрату, т. Е. Окру-ються реакційного центру. Так, електронодонорні заступники (+ I-, + М-ефект) збільшують електронну щільність в бензольному ядрі, що призводить до зростання реакційної здатності субстрату; такі заступники орієнтують електрофіл в реакціях в орто -, пара-положення (орто- і пара - орієнтанти, або орієнтанти пер-вого роду). Електроноакцепторні заступники (-М-ефект), на-проти, знижують електронну щільність в бензольному кільці, що призводить до зниження реакційної здатності реакційного центру субстрату; такі заступники орієнтують електрофіл в мета - положення (мета -оріентанти, або орієнтанти другого роду).