Пірол - хімічна енциклопедія
Піроліл. мовляв. м. 67,09; бесцв. рідина з запахом хлороформу. повільно темніє при стоянні на повітрі; т. кип. 130 ° С, т.пл. -23,4 0 C; 0,9698; 1,5086; m 5,17 · 10 -30 Кл · м (чисте в-во), 6,00 · 10 -30 Кл · м (р-р в бензолі. циклогексане); -2364,2 кДж / моль. Гігроскопічний, змішується у всіх відносинах з більшістю орг. r -рітелей, погано розчин. в воді (6 г в 100 г води при 25 0 C). Молекула пиррола плоска, полярна, напрямок диполя-від атома N всередину кільця. Пірол-гетероароматіч. соед .; ароматич. система утворена 2 парами електронів від подвійних зв'язків і неподіленої парою електронів атома N (p -ізбиточний гетероцикл). Піррол- N H-кислота (рКа 17,5, вода). При обробці Na або К або їх амидами в рідкому NH3. а також р-цією з металом в інертному р-телеглядачам отримують Na- і К-солі пиррола, к-які Алкілуючі і ацилуючий по атому N. літієвих сіль отримують взаємодією пиррола з Li в рідкому NH3 або з бутил- або феніллітіем в ефірному р -ре. N-Заміщені пиррола металліруются бутил- або феніллітіем в положення 2. З реактивами Гриньяра в ефірі пірол легко утворює N-пірролмагніевие похідні, к-які Алкілуючі і ацилуючий по атому С-2. Для пиррола характерні р-ції електрофор. заміщення, к-які переважно. йдуть по a -вуглецевим атомам. Протонирование пиррола мінер. к-тами призводить до порушення ароматичності системи і викликає полімеризацію (утворюється т. зв. пірол-червоний). Нітрування пиррола ацетілнітратом призводить до 2-нітропірролу з домішкою 3-нітропохідного; сульфування комплексом піридин-SO3 при 100 0 C- до утворення пірол-2-сульфо-кислоти. При р-ції пиррола з галогенами дуже легко утворюється тетрагалогенпіррол. Активні алкілгалогеніду (алліл- і бензілгалогеніди) у присутності. слабких основ Алкілуючі пірол в положення 2 і 5, CH3 I при 100-150 0 C-також і в положення 3 і 4. Ацилирование пиррола оцтовим ангідридом при 100 0 C призводить до суміші 2-ацетил-і 2,5-діацетілпірролов. Наявність в положенні 1 електроноакцепторні фенілсуль-фонільной групи змінює орієнтацію електрофор. заміщення: ацилирование 1-фенілсульфонілпіррола по Фріду-лю-Крафтс селективно йде по положенню 3. Під дією HCN, HCl і POCl3 в ДМФА або CHCl3 в лужному середовищі пірол форматується з утворенням 2-форміл-пиррола. При використанні CHCl3 через утворення діхлоркарбена йде побічна р-ція з утворенням 3-хлорпіридин:
За р-ції манних пірол превращ. в 2-діалкіламінометіл-пірол. З активир. алкенами (ефіри акрилової к-ти, акрилонитрил. малеїновий ангідрид та ін.) у присутності. к-т або підстав пірол вступає в р-цію, подібну р-ції Міхаеля, з утворенням продуктів алкілування в положення 2 і 5. При нагр. з водним розчином (NH4) 2 CO3 під тиском пірол карбоксіліруется до аммониевой солі пірол-2-карбоно-вої к-ти. У нейтральній або слабокислою середовищі вступає в р-цію азосочетанія з утворенням 2-азопроізводного, в лужних середовищах дає біс-азопроізводное, напр .:
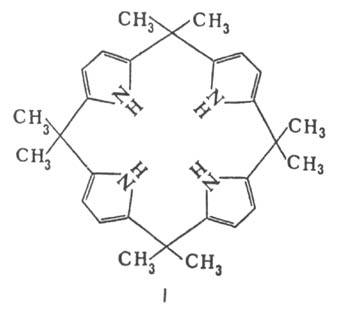
З ацетоном в кислому середовищі пірол утворює циклич. тетрамер ф-ли I.
При помірних т-ре і тиску пірол легко гідруван в піролідин (кат.А-Pt, Pd, Ni-Ренея). При відновленні за допомогою Zn і HCl м. Б. виділено 3-пірролін. Повітрям на світлі пірол окислюється в имид бурштинової к-ти, хромової к-тій-в малеініміда.
У солянокислом розчині n-диметиламінобензальдегіду (реактив Ерліха) пірол дає червоне забарвлення, з SeO2 у водному розчині - фіолетове, з ізатин утворює синій осад. Ідентифікують пірол зазвичай у вигляді комплексу з HgCl2 (т.пл. 143 0 C).
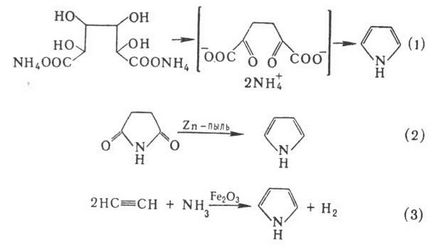
Отримують пірол перегонкою аммониевой солі слизової к-ти (варіант синтезу Паален-Кнорра, р-ція 1), перегонкою ними-да бурштинової к-ти з цинковим пилом (2), пропусканням ацетилену і NH3 через прокаленную трубку у присутності. оксидів Fe (III) або Pb (3), каталитич. аммонолізом фурану або тиофена у присутності. Al2 O3 (р-ція Юр'єва):
П іррол помірно токсичний; його пари викликають стійке і завзяте підвищення т-ри тіла; ЛД50 74 мг / кг (кролики, перорально).
П іррол використовують для синтезу піролідину і деяких лек. ср-в. Він вперше був відкритий F. F. Рунге в 1834 в кам.-уг. смолі; в чистому вигляді отримано T. Андерсоном в 1858 при сухій перегонці рогів і копит.
Літ. Загальна органічна хімія. пер. з англ. т. 8, M. 1985, с. 332-88; Gossauer A. Die Chemie der Pyrrole, В. 1974; J ones R. А. Be a n G. P. The chemistry of pyrroles, N. Y.-L. 1977; Anderson H. J. Loader C. E. "Synthesis", 1985, N 4, p. 353-64. M. А. Юровская.