Основні типи хімічного зв'язку
Тверде тіло складається з частинок, які при їх достатньому зближенні зв'язуються між собою силами взаємодії. Частинками можуть бути атоми, іони або молекули. Для стійкості структури твердого тіла необхідно рівновагу сил тяжіння і відштовхування між частинками. Прийнято розділяти зв'язку між частинками в твердих тілах на наступні. Зв'язок Ван-дер-Ваальса, іонна (полярна), ковалентний. металева і воднева.
Є найбільш загальним видом зв'язку, який існує у всіх з'єднаннях атомів і молекул. Вперше вони були застосовані для обґрунтування рівняння стану реальних газів - рівняння Ван-дер-Ваальса
в якому визначають поправки, пов'язані з дією сил тяжіння a / V 2 і відштовхування b між молекулами реального газу. Практично в чистому вигляді такі сили проявляються між молекулами з насиченими хімічними зв'язками (O2. H2. І ін.), А також між атомами інертних газів в їх рідкому і твердому стані. Зв'язок Ван-дер-Ваальса включає в себе три взаємодії:
Дисперсійне взаємодія. Розглянути це взаємодія можна на прикладі двох атомів гелію (рисунок 1). В атомі гелію розподіл електронної щільності сферически симетрично, тобто середній електричний момент атома дорівнює нулю. У різні моменти часу електрони розташовані в певних точках простору, створюючи миттєві швидко мінливі електричні диполі. При зближенні двох атомів гелію в русі їх електронів встановлюється кореляція (погодження), яка призводить до виникнення сил взаємодії. Такі сили можуть мати двоякий характер. Якщо рух електронів скоррелировано так, як показано на малюнку 1 а, то між миттєвими диполями виникає тяжіння, яке призводить до зв'язку атомів. У разі, зображеному на малюнку 1 б, атоми будуть відштовхуватися. У першому варіанті (рисунок 1, а) енергія системи знижується, тому цей випадок є більш ймовірним, це і обумовлює появу постійно діючої сили тяжіння між атомами гелію. Такі сили зв'язку називаються дисперсійними.
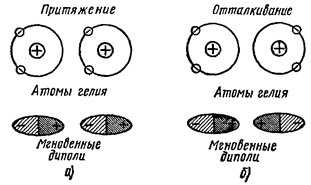
Малюнок 1. Дисперсійне взаємодія.
Для таких сил в 1930 р був проведений вперше розрахунок Лондоном. В основі моделі розрахунку був наведений диполь в атомі, який виникає під впливом миттєвого електричного диполя іншого атома, що призводить до реалізації конфігурації на малюнку 1, а. В результаті розрахунку вираз для енергії дисперсійного взаємодії дорівнює:
Орієнтаційні взаємодія. Коли молекули володіють постійним дипольним моментом M, т. Е. Є полярними, то між ними відбувається електростатичне взаємодія, що прагне розташувати ці молекули в строгому порядку (малюнок 1.2), так як в цьому положенні енергія системи зменшується.
Орієнтація молекул при низьких температурах максимально повна і енергія взаємодії визначається співвідношенням
Де r - межмолекулярное відстань, - діелектрична постійна.
Для високих температур, як визначив Кеєзом, енергія взаємодії дипольних молекул визначається формулою
Розглянуте взаємодія називається орієнтаційний.
Индукционное взаємодія. У полярних молекул, які мають високу поляризуемостью, може виникати наведений (індукований) момент під впливом поля постійних диполів сусідніх молекул. Дебай показав, що енергія тяжіння між жорстким диполем першої молекули і індукованим диполем другий молекули не залежить від температури і визначається співвідношенням
Дане взаємодія називається індукційним, або деформаційних.
При зближенні двох молекул в загальному випадку можуть виникати всі три види зв'язку, і енергія взаємодії складається з розглянутих вище енергій
Внесок кожної частини в загальну енергію при Ван-дер-ваальсово зв'язку різний в залежності від молекули.
Єпіфанов Г.І. Фізика твердого тіла.