Хімічна зв'язок
МЕТОД валентного зв'язку
Еволюція методу валентних зв'язків
Далі Гейтлер і Лондон припустили, що знайдена ними залежність хвильової функції від координат зберігається і при зближенні атомів водню. При цьому, однак, необхідно вже враховувати і ті взаємодії (між ядрами, між електронами і т. Д.), Якими при значній відстані атомів один від одного можна було нехтувати. Ці додаткові взаємодії розглядаються як деякі поправки ( «обурення») до вихідного стану електронів в вільних атомах водню.
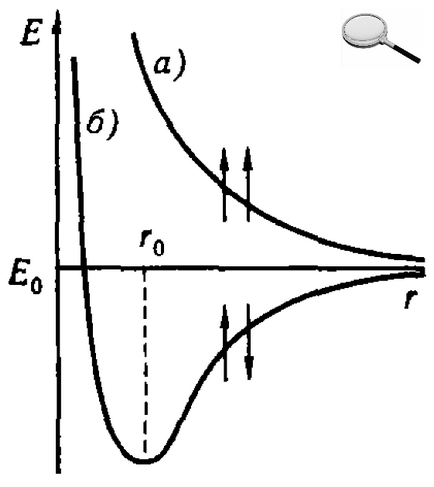
В результаті були отримані рівняння, що дозволяють знайти залежність потенційної енергії Е системи, що складається з двох атомів водню, від відстані r між ядрами цих атомів. При цьому виявилося, що результати розрахунку залежать від того, однакові або протилежні за знаком спини взаємодіючих електронів. При збігається напрямку спинив зближення атомів приводить до безперервного зростанню енергії системи. В останньому випадку для зближення атомів потрібно витрата енергії, так що такий процес виявляється енергетично невигідним і хімічний зв'язок між атомами не виникає. При протилежно спрямованих спинах зближення атомів до деякої відстані го супроводжується зменшенням енергії системи. При r = r0 система має найменшу потенційною енергією, тобто знаходиться в найбільш стійкому стані; подальше зближення атомів знову призводить до зростання енергії. Але це і означає, що в разі протилежно спрямованих спинив електронів утворюється молекула Н2 - стійка система з двох атомів водню, що знаходяться на певній відстані один від одного.
Утворення хімічного зв'язку між атомами водню є результатом взаємопроникнення ( «перекривання») електронних хмар, що відбувається при зближенні взаємодіючих атомів. Внаслідок такого взаємопроникнення щільність негативного електричного заряду в меж'ядерном просторі зростає. Позитивно заряджені ядра атомів притягуються до області перекривання електронних хмар. Це тяжіння переважає над взаємним відштовхуванням однойменно заряджених електронів, так що в результаті утворюється стійка молекула.
Таким чином, проведене дослідження дозволило зробити висновок, що хімічний зв'язок в молекулі водню здійснюється шляхом утворення пари електронів з протилежно спрямованими спинами, що належить обом атомам. Розроблена на цій основі теорія хімічного зв'язку і для більш складних молекул отримала назву методу валентних зв'язків. Важливим положенням є те, що всякий раз, коли хімічний зв'язок утворюється, спини пари електронів повинні бути антипаралельними. Це знаходиться у відповідності з принципом Паулі і підкреслює, що при утворенні хімічного зв'язку електрони переходять в нове квантовий стан.
Наявність спарених електронів є «індикатором» наявності хімічного зв'язку, але не причиною її утворення. Вивчення причини утворення хімічного зв'язку до теперішнього часу показало, що енергія системи з двох атомів знижується тоді, коли електрони з більшою ймовірністю знаходяться в меж'ядерном просторі (як би «затримуються» в цій області). Така затримка призводить до зниження їх кінетичної енергії, в результаті негативна складова повної енергії молекули переважає, молекула стає стійкою або, як кажуть, утворюється хімічний зв'язок.
Метод валентних зв'язків дав теоретичне пояснення найважливіших властивостей ковалентного зв'язку, дозволив зрозуміти будову великого числа молекул. Хоча цей метод не виявився універсальним і в ряді випадків не в змозі правильно описати структуру і властивості молекул, все ж він відіграв велику роль у розробці квантово-механічної теорії хімічного зв'язку і не втратив свого значення до теперішнього часу в якісному розумінні природи хімічного зв'язку.
Основні положення методу валентних зв'язків
Метод валентних зв'язків описує механізм виникнення ковалентного зв'язку і базується на таких основних принципах:
- Хімічна зв'язок між двома атомами здійснюється за рахунок однієї або декількох загальних електронних пар.
Обидва електрона загальної електронної пари утримуються одночасно двома ядрами, що енергетично більш вигідно, ніж знаходження кожного електрона в поле «свого» ядра.
Така хімічна зв'язок є двухцентровой.
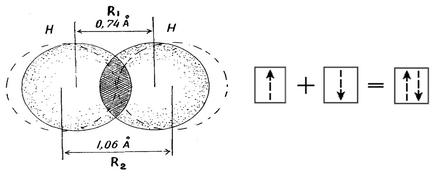
- При утворенні загальної електронної пари електронні хмари перекриваються; область підвищеної електронної щільності між ядрами сприяє їх тяжінню. Чим сильніше перекривання електронних хмар (співвідношення R1 і R2), тим міцніше хімічний зв'язок.
Наприклад. зобразимо освіту молекули F2 за допомогою квантових осередків зовнішнього енергетичного рівня (електронна формула атома F. 1s 2 2s 2 2p 5):
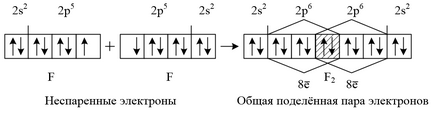
Сприяння електрони зовнішнього рівня атома для утворення хімічних зв'язків з іншими атомами повинні роз'єднуватися (розпарювати). Атом перейде в нове валентний стан. Витрата енергії на такий процес збудження атома компенсується енергією, що виділяється при утворенні хімічного зв'язку (слід пам'ятати, що можливості збудження атомів обмежені числом вільних орбіталей у відповідних енергетичних подуровнях).
- Ковалентний зв'язок має властивість насичуваності, внаслідок чого молекули мають цілком певний склад.
Наприклад. при утворенні молекули метану СН4 кожен з чотирьох неспарених електронів порушеної атома вуглецю з'єднався з електроном атома водню, утворилися 4 ковалентні зв'язки; більше електронних пар в даному випадку утворитися не може, молекули СН5. СН6 і т.д. не існують.
(Примітка: взаємодія валентнонасищенних з'єднань між собою можливо з утворенням однієї або декількох додаткових донорно-акцепторних зв'язків з особливому механізму).
- Ковалентний зв'язок спрямована в просторі, що обумовлює просторову структуру молекул (властивість спрямованості).
Залежно від того, якими електронами здійснюються зв'язку - s-, р-, d- або f- електронами, істотно різні енергії зв'язків, довжини зв'язків, а також їх напрям в просторі.
Електронні хмари мають різну форму, тому їх взаємне перекривання здійснюється декількома способами: розрізняють σ- (сигма), π- (пі) і δ (дельта)-зв'язку.
Якщо перекривання електронних хмар відбувається уздовж лінії, що з'єднує ядра - це σ- зв'язок; якщо хмари перекриваються поза цією лінії, виникають π- і δ-зв'язку.
Якщо між атомами виникла одна загальна електронна пара (зазвичай σ- зв'язок), такий зв'язок називається одинарної, якщо дві і більше, то кратної: подвійний, потрійний.
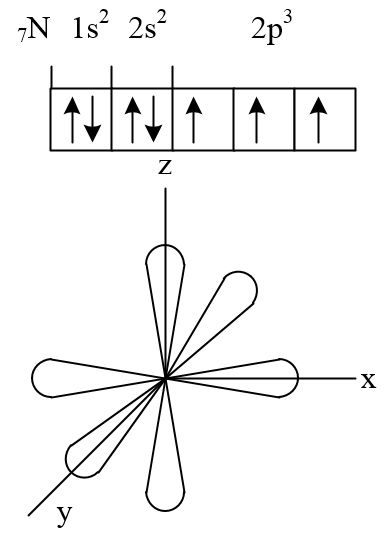
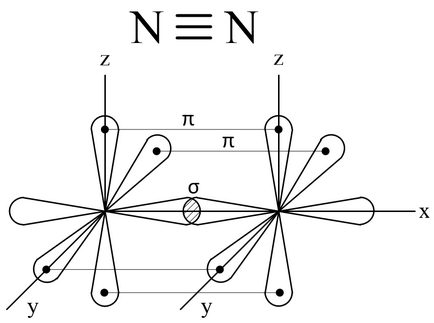
Наприклад. освіту молекули азоту N2 здійснюється трьома загальними електронними парами. У кожного атома азоту в утворенні зв'язків бере участь 3 неспарених р-електронів, спрямованих в тривимірному просторі під кутом 90 0 один до одного і орієнтованих відповідно по осях х, у, z (такі властивості р -подуровня і р -орбіталей, які диктуються магнітним квантовим числом ).
Два атома азоту, з'єднуючись в молекулу N2. можуть утворити одну σ- зв'язок (перекриваються хмари, орієнтовані вздовж осі х) і дві π- зв'язку (перекриваються хмари, орієнтовані вздовж осей у і z).
Гібридизація атомних орбіталей
Cтруктура молекул залежить перш за все від виду і властивостей тих орбіталей, які атоми надають для утворення хімічних зв'язків. Але, крім цього фактора, на просторову будову молекул впливає явище гібридизації орбіталей.
Гибридизацией називається утворення нових рівноцінних за формою і енергії орбіталей з орбіталей різного типу. Змішані, гібридні орбіталі на схемах зображують умовно:
sp-гібридизація
З однієї s орбіталі і однієї р орбіталі утворюються дві гібридні, змішані орбіталі sp-типу, спрямовані по відношенню один до одного на 180 °.
Наприклад: лінійну форму мають молекули ВеН2 і SnCl2 з sp-гібридизація атома берилію і олова відповідно.
sp 2-гібридизація
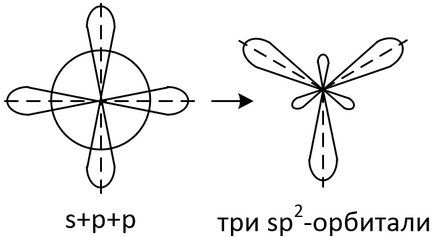
З однієї s орбіталі і двох р -орбіталей утворюються три sp 2 -гібрідние орбіталі, розташовані в одній площині під кутом 120 ° один до одного.
Взаємна орієнтація трьох sp 2 -гібрідних орбіталей - трігональная. Концепцію sp 2-гібридизації застосовують для опису плоских молекул тригональной форми.
Наприклад: молекула фториду алюмінію A1F3. Порушення атома алюмінію супроводжується розпарюванням s 2-електронів зовнішнього рівня на p -подуровень. Отже, електронна конфігурація зовнішнього рівня атома алюмінію в збудженому стані - 3s 1 3p 2. Заселені електронами орбіталі атома алюмінію гібрідізіруют і орієнтуються в одній площині під кутом 120 ° один до одного. Кожне з трьох електронних хмар гібридних sp 2 -орбіталей перекривається з електронними хмарами p орбіталей трьох атомів фтору.
sp 3-гібридизація
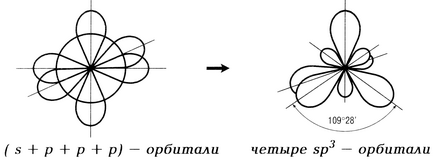
sp 3-гібридизація має місце, якщо об'єднуються одна s орбіталь і три р орбіталі; утворюються чотири sp 3 -гібрідние орбіталі, орієнтовані вже не в одній площині, а в обсязі тетраедра і спрямовані від центру тетраедра до його 4 вершин; валентний кут між двома хімічними зв'язками становить 109 ° 28 '.
Наприклад: будова молекули метану СН4. Атом вуглецю в збудженому стані має чотири неспарених електрона: один s- і три р- електрона. Здавалося б, чотири хімічні зв'язки, утворені ними з s- електронами чотирьох атомів водню, повинні бути нерівноцінними. Однак експериментально встановлено, що всі 4 зв'язку в молекулі СН4 абсолютно ідентичні по довжині і енергії, а кути між зв'язками становлять 109 ° 28 '. Отже, в молекулі СН4 має місце sp 3-гібридизація.
Можливі більш складні випадки гібридизації за участю d-електронів, (наприклад, sp 3 d 2 - гібридизація).
Явище гібридизації, тобто змішання, вирівнювання електронної щільності, енергетично вигідно для атома, оскільки у гібридних орбіталей відбувається більш глибоке перекриття і утворюються більш міцні хімічні зв'язки. Невеликі витрати енергії на збудження атома і гібридизацію орбіталей з надлишком компенсуються енергією, що виділяється при виникненні хімічних зв'язків. Валентні кути диктуються міркуваннями максимальної симетрії і стійкості.
На гібридних орбіталях, як і на звичайних орбиталях, може розташовуватися не тільки по одному електрону, але і по два. Наприклад, чотири sp 3 -гібрідние орбіталі атома кисню О такі, що дві з них містять по парі електронів, а дві - одному неспарених електронів. З сучасних позицій будова молекули води розглядається з урахуванням гібридизації орбіталей атома О і тетраедричних структури молекули Н2 O в цілому.
Валентність за обмінним механізмом методу
Здатність атома приєднувати або заміщувати певне число інших атомів з утворенням хімічних зв'язків називається валентністю. Згідно обмінним механізмом методу валентних зв'язків кожен атом віддає на утворення спільної електронної пари (ковалентного зв'язку) по одному неспарених електронів. Кількісною мірою валентності в обмінному механізмі методу валентних зв'язків вважають число неспарених електронів у атома в основному або збудженому стані атома. Це неспарені електрони зовнішніх оболонок у s- і p- елементів, зовнішніх і предвнешнего оболонок у d- елементів, зовнішніх, предвнешнего і предпредвнешніх оболонок у f-елементів.
При утворенні хімічного зв'язку атом може переходити в збуджений стан в результаті роз'єднання пари (або пар) електронів і переході одного електрона (або декількох електронів, що дорівнює числу роз'єднаних пар) в вільну орбіталь тієї ж оболонки.
Наприклад: електронна конфігурація кальцію в основному стані записується як:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
Відповідно до обмінним механізмом методу валентних зв'язків валентність його дорівнює нулю В = 0. У атома кальцію в четвертій оболонці (n = 4) є вакантні р- орбіталі. При порушенні атома відбувається розпарювання електронів і один з 4s-електронів переходить у вільну 4р орбіталь. Валентність кальцію в збудженому стані дорівнює двом, тобто при розпарюванні валентність збільшується на дві одиниці:
На відміну від кисню і фтору, електронні пари яких не можуть роз'єднуватися, так як у другій оболонці немає вакантних орбіталей, електронні пари атомів сірки і хлору можуть розпарювати в вакантні орбіталі 3d -подоболочкі, відповідно сірка крім валентності основного стану 1 і 2. має ще валентності 4 і 6 в збудженому стані, а хлор крім валентності 1 в основному стані, має валентності 3, 5 і 7 в збудженому стані.
Електронні конфігурації атомів деяких злементов в основному і збудженому станах