Курс хімія 8 клас, дистанційний курс, хімія, 8 клас оксиди основні хімічні властивості і
Ви познайомилися з класом "Оксиди", класифікацією оксидів.
Дуже важливо навчитися розрізняти кислотні, основні оксиди, так як продукти взаємодії їх з водою представляють різні класи неорганічних сполук.
Якщо ще ці оксиди ви розрізняєте погано, потрібно повернутися до попереднього уроку і розібратися, чим відрізняються кислотні оксиди від основних.
Сподіваюся, що ви навчилися розрізняти основні і кислотні оксиди.
І так, хімічні властивості оксидів:
1. Взаємодія оксидів з водою. В результаті взаємодії розчинних оксидів з водою утворюються гідроксиди. Іншими словами, якщо оксиду відповідає розчинний гідроксид, то реакція оксиду з водою можлива.
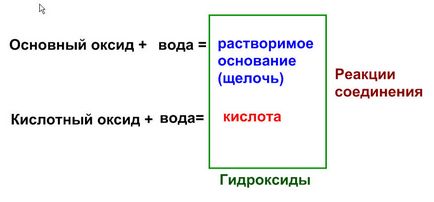
1) Взаємодія основних оксидів з водою.
Міркуємо так. Оксид натрію - це основний оксид, так як це оксид металу з валентність дорівнює 1. Згідно представленій схемі, реакція йде з утворенням розчинної підстави.
Складаємо формулу отриманого підстави:
Валентність натрію дорівнює 1, отже формула гідроксиду натрію
Згідно таблиці розчинності - це розчинна підставу (луг), отже така реакція можлива.
Складемо повне рівняння:
Na2O + H2O = 2NaOH
Так як оксид барія- це основний оксид, то йому відповідає підстава - Ba (OH) 2. Якщо ви пам'ятаєте, то кількість гідроксильних груп визначається по валентності металу. Барій - елемент 2 групи, валентність дорівнює 2.
По таблиці розчинності визначаємо, що це розчинна підставу (луг). Отже, така реакція можлива.
Рівняння реакції: BaO + H2O = Ba (OH) 2
Приклад 3.
Основному оксиду міді (II) відповідає підставу Cu (OH) 2. Дане підставу є нерозчинним (див. Таблицю розчинності). Отже, така реакція протікати не може.
При написанні подібних рівнянь реакцій користуйтеся подібними міркуваннями.
2.Взаімодействіе кислотних оксидів з водою
Оксид сірки (IV) є кислотним, так як це оксид неметалла, в якому сірка виявляє валентність рівну 4.
Складемо формулу відповідної кислоти. У кислотах на першому на першому місці пишеться водень, а кисень на останньому місці. Запишіть по порядку знаки: водень, сірка, кисень. Число атомів кожного елемента визначаємо по лівій частині рівняння:
SO2 + H2O = H2SO3
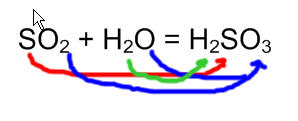
Зверніть увагу, що формули гідроксидів кислот виходять простим додаванням формул оксидів і води. Цим прийомом можна скористатися і тоді, коли просто потрібно скласти формулу відповідає даному оксиду кислоти.
P2O5 + H2O = [H2P2O6] = 2HPO3 або P2O5 + 3H2O = 2H3PO4
Формула в квадратних дужках - це проміжна запис в разі, якщо число атомів всіх елементів - це парні числа. Скоротимо на 2, отримаємо потрібну формулу. 2 стає коефіцієнтом. У другому випадку в гарячій воді утворюється ортофосфорна кислота (формулу ви вже вивчили). Коефіцієнти розставлені відомим вам способом.
Запам'ятайте: кислоти і підстави мають загальну назву - гідроксиди.
Взаємодія основних і амфотерних оксидів з кислотами.
Основний оксид + кислота = сіль і вода.
Дані реакції протікають по типу обміну.
Приклад 1.
BaO + HNO3
в правій частині рівняння необхідно скласти формулу солі: запишіть поруч метал, який утворює основний оксид - Ba, і кислотний залишок азотної кислоти NO3. Складіть формулу солі по валентності, допишіть формулу води в правій частині рівняння і розставте коефіцієнти.
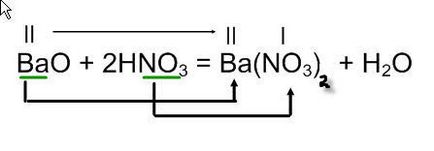
В результаті реакції оксиду барію з азотною кислотою утворюється нітрат барію і вода.
Приклад 2.
K2O + H2SO4 =
В отриманій в результаті реакції солі (в правій частині рівняння) пишемо на першому місці метал калій, на другому-кислотний залишок сірчаної киcлот SO4
Згідно валентності складемо формулу солі, допишемо формулу води і перевіримо коефіцієнти.
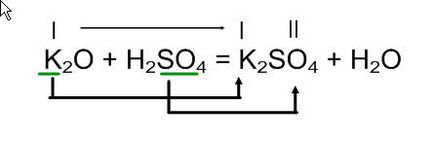
В результаті взаємодії оксиди калію з сірчаною кислотою утворюються сульфат калію і вода.
Подібні рівняння реакцій складайте по даному алгоритму.
Кислотні оксиди взаємодіють з розчинними підставами (лугами). Згадайте, які підстави відносяться до групи лугів.
Кислотний оксид + луг = сіль + вода
Приклад 1.
KOH + CO2 =
У цьому випадку, щоб скласти формулу солі, необхідно розуміти, яка кислота відповідає кислотному оксиду.
У правій частині рівняння запишіть складові частини солі: метал підстави K і кислотний залишок CO3 тієї кислоти H2CO3. яка відповідає кислотному оксиду CO2. Потім складіть згідно валентності формулу солі, допишіть в правій частині рівняння воду і розставте коефіцієнти.
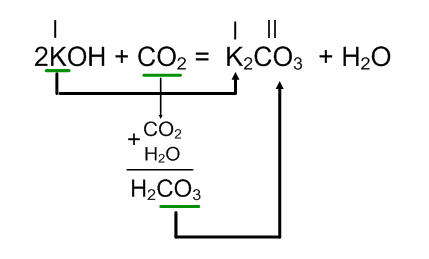
В результаті взаємодії гідроксиду калію (луг) з вуглекислим газом (оксид вуглецю (IV)) утворюються карбонат натрію і вода.
Приклад 2.
Ba (OH) 2 + SO3
Складаємо рівняння за вище описаним алгоритмом:
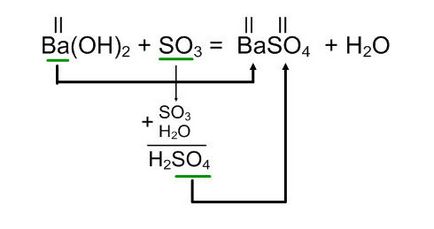
В результаті взаємодії гідроксиду барію з оксидом сірки (VI) утворюється сульфат барію і вода.
Відпрацюйте уважно даний алгоритм дій.
І ще одна спільна властивість оксидів:
Взаємодія кислотних і основних оксидів між собою.
Кислотний оксид + основний оксид = сіль
Приклад 1.
Na2O + P2O5 =
В результаті реакції виходить сіль тієї кислоти, яка відповідає даному оксиду. Алгоритм дій схожий на алгоритм складання рівнянь взаємодії кислотного оксиду з підставою.
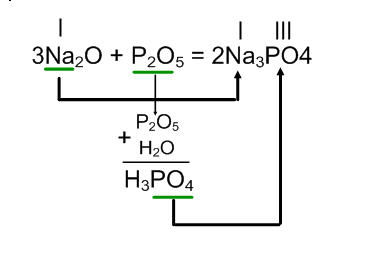
В результаті реакції оксиду натрію з оксидом фосфору (V) утворюється фосфат натрію.
Приклад 2.
BaO + SO3 =
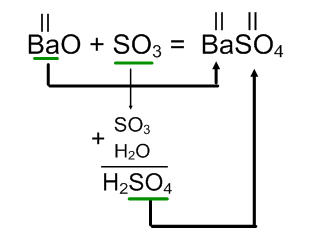
В результаті взаємодії оксиду барію з оксидом сірки (VI) утворюється сульфат барію.
Відпрацюйте цей алгоритм дій.
Ми розібрали хімічні властивості оксидів, які є загальними для солеобразующіе (кислотних, основних) оксидів. Зі специфічними властивостями оксидів ми будемо поступово знайомитися в інших темах.
Підіб'ємо підсумки і представимо загальні властивості кислот і отримання у вигляді таблиць.
Таблиця 1. Хімічні властивості.