Хімічні властивості спиртів

Головна | Про нас | Зворотній зв'язок
Дисоціація спиртів на іони відбувається в незначній мірі, тому спирти дають нейтральну реакцію - в їх присутності не змінюється забарвлення лакмусу або фенолфталеїну.
Кислотні властивості спиртів виражені дуже слабо. Нижчі спирти бурхливо реагують з лужними металами з утворенням алкоголятов (в даному прикладі - етілалкоголята калію):
Спирти вступають в реакції заміщення з галогеноводородами:
З кислотами (органічними або неорганічними) спирти вступають в реакцію етерифікації в присутності сірчаної кислоти з утворенням складних ефірів:
оцтова етиловий ефір
кислота оцтової кислоти
При нагріванні спирту в присутності сильної кислоти відбувається відщеплення молекули води від двох молекул спирту в результаті міжмолекулярної дегідратації і утворюється простий ефір (в даному прикладі - діетиловий ефір):
Діетиловий або сірчаний ефір - хороший розчинник багатьох органічних речовин, застосовується для чищення тканин, а в медицині - при хірургічних операціях, так як має анестезуючу дію.
Спирти вступають в реакції відщеплення води - елімінування. або внутрімолекулярної дегідратації. з утворенням ненасичених вуглеводнів. Дана реакція стає переважаючою при використанні великих кількостей кислоти:
Спирти ступають в реакції окислення. Окислення - це процес збільшення числа атомів кисню в молекулах органічних сполук і зменшення числа атомів водню. Первинні спирти окислюються в альдегіди, які, в свою чергу, можуть окислюватися в карбонові кислоти:
Вторинні спирти окислюються в кетони:
Третинні спирти більш стійкі до окислення. При дії на них сильних окислювачів може відбуватися розщеплення вуглецевого скелета молекули третинного спирту з утворенням карбонових кислот і кетонів з меншим числом вуглецевих атомів, ніж в молекулі вихідного теоретичного спирту. Окислення зазвичай проводять дихроматом або перманганатом калію з сірчаною кислотою.
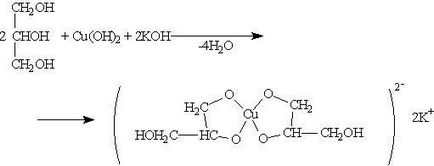
При взаємодії гідроксиду міді (II) з гліцерином і іншими багатоатомних спиртами відбувається розчинення гідроксиду і утворюється комплексна сполука синього кольору. Ця реакція використовується для виявлення багатоатомних спиртів:
Для багатоатомних спиртів характерне утворення складних ефірів. Зокрема, при реакції гліцерину з азотною кислотою в присутності каталітичних кількостей сірчаної кислоти утворюється тринитрат гліцерину (нітрогліцерин):
Застосування спиртів: етиленгліколь застосовують:
1) в якості антифризу; 2) для синтезу високомолекулярних сполук (наприклад, лавсану).
1) в парфумерії і в медицині (для виготовлення мазей, що пом'якшують шкіру); 2) в шкіряному виробництві та в текстильній промисловості;
3) для виробництва нітрогліцерину.
Органічні сполуки, в молекулі яких є карбонільної група> С = O, називаються карбонільних сполуками, або оксосполук. Карбонільні сполуки діляться на дві великі групи - альдегіди і кетони.
Альдегіди містять в молекулі карбонільну групу, пов'язану з атомом водню, т. Е. Альдегідну групу - СН = O. Кетони містять карбонільну групу, пов'язану з двома вуглеводневими радикалами, т. Е. Кетонну групу.
Залежно від будови вуглеводневих радикалів альдегіди і кетони бувають аліфатичними, аліциклічними і ароматичними.
Ізомерія альдегідів пов'язана тільки з будовою радикалів. Ізомерія кетонів пов'язана з будовою радикалів і з положенням карбонільної групи в вуглецевого ланцюга.
Номенклатура. Для альдегідів часто використовують тривіальні назви, відповідні назвам кислот (з тим же числом вуглецевих атомів), в які альдегіди переходять при окисленні. При складанні назви альдегіду вказується назва відповідного вуглеводню, до якого додається суфікс «аль». наприклад, формальдегід Н2 С = О, етаналь Н3 СС (Н) = О, пропаналь Н3 ССН2 С (Н) = О.
CH3 -CHO - ацетальдегід - етанальCH3 -CH2 -CHO - пропіональдегід - пропанальCH3 -CH2 -CH2 -CHO - бутіральдегід - бутанальCH2 = CH-CHO - акролеїн (акрілальдегід) - пропенальС6 H5 -CHO - бензальдегід
У більш складних випадках вуглецевий ланцюг групи R нумерують, починаючи з карбонільного вуглецю, потім за допомогою числових індексів вказують положення функціональних груп і різних заступників.
На відміну від альдегідної, кетонна група> C = O може перебувати також у середині вуглеводневого ланцюга, тому в простих випадках вказують назви органічних груп (згадуючи їх в порядку збільшення) і додають слово «кетон»: диметилкетон CH3 -CO-CH3. метилетилкетон CH3 CH2 -CO-CH3. У більш складних випадках положення кетонної групи в вуглеводневого ланцюга вказують цифровим індексом, додаючи суфікс «він». Нумерацію вуглеводневого ланцюга починають з того кінця, який знаходиться ближче до кетонної групі.
У молекулі кетону радикали можуть бути однаковими або різними. Тому кетони, як і прості ефіри, діляться на симетричні і змішані.
Будова оксо-групи. Альдегіди характеризуються високою реакційною здатністю. Велика частина їх реакцій обумовлена наявністю карбонільної групи. Атом вуглецю в карбонільної групи знаходиться в стані sp 2-гібридизації і утворює три # 963; - зв'язку (одна з них - зв'язок С-О), які розташовані в одній площині під кутом 120 0 один до одного.
Схема будови карбонільної групи
Найважливішими реакціями альдегідів є реакції нуклеофільного приєднання по подвійному зв'язку карбонільної групи.
1. Реакція з синильною кислотою. Однією з типових реакцій нуклеофільного приєднання альдегідів є приєднання синильної (синильної) кислоти, що приводить до утворення # 940; - оксінітрілов:
2. Взаємодія зі спиртами. Альдегіди можуть взаємодіяти з однією або двома молекулами спирту, утворюючи відповідно напівацеталі і ацетали. Напівацеталю називаються сполуки, що містять при одному атомі вуглецю гидроксильную і алкоксильной групи. Ацеталі - це з'єднання, що містять при одному атомі вуглецю дві алкоксильной групи:
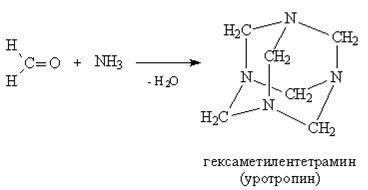
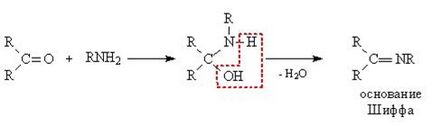
3. Взаємодія з аміаком і амінами. Реакція взаємодії з аміаком і амінами йде по типу «приєднання-відщеплення», на першій стадії відбувається приєднання аміаку або аміну, а на другій стадії відбувається відщеплення води з утворенням подвійного зв'язку між карбонільним атомом вуглецю і атомом азоту аміногрупи. Таким чином, утворюються сполуки, звані підставами Шиффа - сполуки, що містять фрагмент> C = NR. З'єднання, утворені приєднанням амінів, називаються імінну. гідроксиламіном - оксими. гидразином - гідразонів.
Продукт взаємодії формальдегіду з аміаком дещо інший - це результат циклізації трьох проміжних молекул, в результаті виходить каркасне з'єднання гексаметилентетрамин, що використовується в медицині як препарат уротропін.