Фібронектин - студопедія
Фібронектин - один з ключових білків міжклітинної матриксу, неколлагенових структурний глікопротеїн, який синтезується і виділяється в міжклітинний простір багатьма клітинами. Він побудований з двох ідентичних поліпептидних ланцюгів, з'єднаних дисульфідними містками у своїх С-решт (рис. 15-19). Поліпептидний ланцюг фибронектина містить 7-8 доменів, на кожному з яких розташовані специфічні центри для зв'язування різних речовин. Фібронектин може пов'язувати
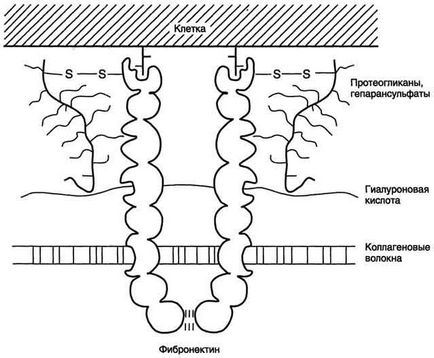
Мал. 15-19. Будова фибронектина.
колаген, протеоглікани, гіалуронову кислоту, вуглеводи плазматичних мембран, гепарин, фермент трансглутаміназу. Завдяки своїй структурі фибронектин може виконувати інтегруючу роль в організації міжклітинної речовини, а також сприяти адгезії клітин. Існує кілька форм фибронектина, які синтезуються різними клітинами. Розчинна, або плазмовий, фибронектин синтезується гепатоцитами. Нерозчинний, або тканинний фибронектин синтезується в основному фібробластами або ендотеліоцитами, гліоціти і епітеліальними клітинами. Обидві форми фібронектину залучаються до різноманітні процеси: сприяють адгезії і поширенню епітеліальних і мезенхімальних клітин, стимулюють проліферацію і міграцію ембріональних і пухлинних клітин, контролюють диференціювання і підтримку цитоскелету клітин, активно беруть участь в запальних і репаративних процесах. Це пов'язано з тим, що кожна субодиниця фибронектина містить послідовність Арг-гли-АСП (RGD), за допомогою якої він може приєднуватися до клітинних рецепторів (Інтегріни). Ці рецептори опосередковано взаємодіють з актиновими микрофиламентами, які знаходяться в цитоплазмі. У цьому процесі беруть участь так звані білки прикріплення (від англ. Attach - прикріплювати proteins): талин, вінкулін, # 945; -актінін (рис. 15-20).
За допомогою таких білок-білкових взаємодій інформація може передаватися з міжклітинної
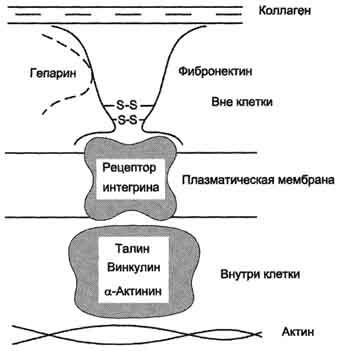
Мал. 15-20. Схема взаємодії фібронектину з інтегринів.
матриксу всередину клітини, а також у зворотному напрямку - з клітини назовні, таким чином впливаючи на які відбуваються в клітині процеси. Відомо також, що фибронектин бере участь в міграції клітин, які можуть приєднуватися до його RGD-ділянкам, і, таким чином, фибронектин як би допомагає їм переміщатися в міжклітинному матриксі. У міжклітинному матриксі, навколишньому трансформовані (або пухлинні) клітини, кількість фібронектину помітно знижений, що може бути однією з причин появи метастазів.
Ламінін - найбільш поширений некол-лагеновий глікопротеїн базальних мембран. Він складається з трьох поліпетідних ланцюгів: А, В1 і В2. Молекула ламініну має хрестоподібну форму з трьома одноланцюжковий гілками і однієї трёхцепочечной гілкою (рис. 15-21). Кожна ланцюг ламініну містить кілька глобулярних і стержневідной доменів, на яких є специфічні центри зв'язування для різних речовин. Ламінін взаємодіє з усіма структурними компонентами базальних мембран, включаючи колаген IV типу, нідоген, фибронектин, ГСПГ. Крім того, молекула ламініну має кілька центрів зв'язування з клітинами. Головні функції ламініну визначаються його здатністю зв'язувати клітини і модулювати клітинне поведінку. Він може впливати на зростання, морфологію, диференціювання і рухливість клітин. Ламінін виконує роль адгезивного білка для різних епітеліальних і мезенхімальних клітин.
Нідоген - сульфатованих глікопротеїн базальних мембран, утворює з ламініном щільний, нековалентно пов'язаний комплекс; сила зв'язування нідоген з колагеном IV типу набагато менше, ніж з ламініном. Цей білок представлений однією поліпептидного ланцюгом, що містить три глобулярних домену (рис. 15-21). Один з доменів нідоген має центр зв'язування ламініну, в області іншого домену знаходиться центр зв'язування колагену IV типу. Таким чином, нідоген може виступати в якості одного з пов'язують мостів між різними компонентами міжклітинного матриксу і брати участь в утворенні потрійних комплексів ламінін-нідоген-колаген. Крім цього, нідоген містить RGD-послідовність і тому може приєднуватися до клітинної поверхні.