Електрофільне приєднання 2
Алкени, алкадіени і Алкіни відомі своєю здатністю легко реагувати з електрофільними реагентами, приєднуючи їх за кратними зв'язками. В результаті взаємодії електрофільного агента Е + з алкенів утворюється карбокатіон, що володіє високою реакційною здатністю. Карбокатіон далі стабілізується за рахунок швидкого приєднання нуклеофільного агента Nu -:
У разі, якщо приєднується симетричний реагент (такий, як Br2), труднощів у визначенні продуктів реакції не виникає. При надлишку реагенту відбувається насичення кратних зв'язків і перетворення алкенів - в дігалогеналкани, алкинов - в тетрагалогеналкани:
Приєднання брому і хлору до алкенам відбувається за іонним, а не по радикальному механізму. Цей висновок випливає з того, що швидкість приєднання галогену не залежить від опромінення, присутності кисню та інших реагентів, що ініціюють або пригнічують радикальні процеси. На підставі великого числа експериментальних даних для цієї реакції було запропоновано механізм, що включає кілька послідовних стадій. На першій стадії відбувається поляризація молекули галогену під дією електронів π-зв'язку. Атом галогену, який отримує деякий дробовий позитивний заряд, утворює з електронами π-зв'язку нестабільний интермедиат, званий π-комплексом або комплексом з перенесенням заряду. Слід зазначити, що в π-комплексі галоген не утворює спрямованої зв'язку з яким-небудь конкретним атомом вуглецю; в цьому комплексі просто реалізується донорно-акцепторна взаємодія електронної пари π-зв'язку як донора і галогену як акцептора.
Далі π-комплекс перетворюється в циклічний бромоніевий іон. В процесі утворення цього циклічного катіону відбувається гетеролітичною розрив зв'язку Br-Br і порожня р орбіталь sp 2 -гібрідізованного атома вуглецю перекривається з р -орбіталей "неподіленої пари" електронів атома галогену, утворюючи циклічний іон бромонія.
На останній, третій стадії аніон брому як нуклеофільний агент атакує один з атомів вуглецю бромоніевого іона. Нуклеофільних атака бромід-іона призводить до розкриття тричленого циклу і утворення віцінальним диброміду (vic-поруч). Цю стадію формально можна розглядати як нуклеофільне заміщення SN2 у атома вуглецю, де групою, що йде є Br +.
Приєднання галогенів до подвійного зв'язку алкенів являє собою одну з формально простих модельних реакцій, на прикладі якої можна розглянути вплив основних факторів, що дозволяють зробити аргументовані висновки про детальний механізм процесу. Однак, коли приєднується несиметричний реагент (а таких переважна більшість) до несиметричного ж алкенами (або заміщення алкенами), передбачити будову продукту стає складніше. У ряді випадків приєднання відбувається за правилом Марковникова:
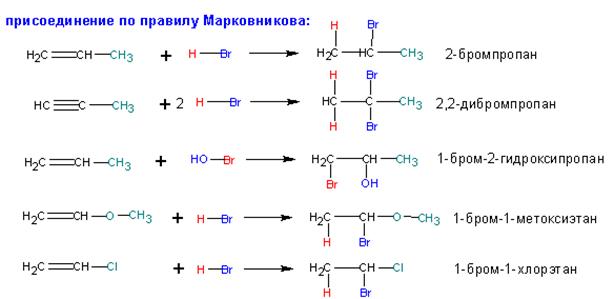
Це відбувається, якщо один із заступників (або обидва) при вуглецю з кратною зв'язком є електронодонорності: алкіл-, метокси, галоген- і т.п.). Якщо заступник електроноакцепторний (ціано-, нітро-, сульфо-, карбокси-, карбонильная і т.п. групи), то приєднання протікає ПРОТИ правила Марковникова:
У таких випадках для передбачення складу продукту слід розглядати інтермедіати реакції - карбкатион, і вирішувати питання про їх відносної стабільності. Освіта продуктів відбувається через перетворення з найбільш стійким проміжним карбкатион:
Питання про порівняльну стійкості карбкатион вирішується просто. "Чисто" алкільні карбкатион збільшують стійкість в ряду:
первинні <вторичные <третичные <аллильные, бензильные
Чим більше алкільних заступників у позитивно зарядженого вуглецю, тим карбкатион стійкіше, внаслідок наростання компенсуючого заряд + I ефекту алкильной групи. Відповідно, слід враховувати вплив електроноакцепторних груп, таких, як:
Будь-яка з цих угруповань, по-перше, ускладнює реакцію електрофільного приєднання в цілому (збіднення електронної щільності С = С зв'язку і дестабілізація карбкатиона), і по-друге, призводить до утворення продуктів ПРОТИ правила Марковникова:
Однак, угруповання, які мають на атомі, пов'язаному з позитивно зарядженим вуглецем карбкатиона, неподеленную пару електронів, збільшують стабільність катіона, і викликають утворення продуктів приєднання по правилу Марковникова. До таких угруповань відносяться: -О -. ОН, -ОR, -NH2. -NHR, -NR2. -X (галоген), -SH, -SR і деякі інші:
Схема компенсації позитивного заряду мезомерним ефектом атома з неподіленої парою електронів виглядає так:
Незважаючи на наявний у всіх заступників негативний індуктивний ефект -I (внаслідок більшої електронегативності), позитивний мезомерний ефект (+ M) в даному випадку відіграє вирішальну роль.
Все сказане відноситься до реакцій електрофільного приєднання. Слід пам'ятати, однак, що приєднання HBr до алкенам, в залежності від умов, може протікати як за механізмом електрофільного приєднання, так і радикальним приєднанням. Склад продуктів реакції повністю визначається механізмом її протікання.
Радикальне приєднання до подвійного зв'язку С = С
Найбільш вивчено відкрите Караш в 1932 році радикальне приєднання бромистого водню, що ініціюється слідами перекису і інгібіруемая гидрохиноном. Відкриття механізму радикального приєднання до подвійних зв'язків поклало кінець суперечностей, які спостерігаються у численних дослідників при приєднанні бромистого водню до несиметричним алкенам: у одних ця реакція приводила до продуктів приєднання проти правила Марковникова, у інших - за правилом Марковникова, у третіх виходила суміш продуктів. Всьому виною виявилося те, що у різних дослідників реакції протікали в різних умовах (і, відповідно, за різними механізмами), що і призводило до неоднозначних продуктам. При проведенні реакції в умовах, характерних для протікання ланцюгових процесів (газова фаза, в индифферентном розчиннику при освітленні, присутність слідів перекисів) в якості інтермедіатів утворюються радикали:
або: а) R-O-O-R à . б) H-Br + à R-OH +
Далі протікає реакція з алкенів, причому алкен атакується радикалом галогену: