Анодне розчинення - хімічна енциклопедія
Анодного розчинення металу. ЕлектроХіт. окислення металу в розчині або розплаві електроліту з утворенням р-рімих продуктів і відведенням звільняються електронів у зовн. ланцюг. У загальному вигляді цей процес можна записати слід. чином:
де М-атом металу. n-число звільняються електронів. Відповідно до законів Фарадея. за відсутності ін. електродних р-ций залежність між швидкістю окислення металу V [г / (см 2 * с)] і щільністю анодного струму i має вигляд:
Анодне розчинення лежить в основі розмірної ЕлектроХіт. обробки металів і сплавів і їх електрополірування, анодного зміцнення металеві. матеріалів шляхом видалення з повітки тонких механічно деформуються. шарів, використання р-рімих анодів при ЕлектроХіт. рафинировании металів і в гальванотехнике. Від анодного розчинення в значить. мірою залежать експер-луатац. характеристики гальваніч. елементів і акумуляторів. а також корозійне поведінку конструкц. металеві. матеріалів.
Найважливіші характеристики анодного розчинення-залежність i від електродного потенціалу Е і приватна похідна зворотній залежності. наз. поляризуемостью і є техн. характеристикою розчиняються анодів. Зазначені залежності можуть мати концентрац. або кінетичної. (Активаційну) природу. Який з випадків реалізується на практиці, залежить від співвідношення між i при цьому Е і струмом обміну iо. тобто щільністю струму при рівноважному потенціалі, коли вона в точності дорівнює щільності струму зворотного процесу - катодного осадження металу. при i
де Ео - електродний потенціал. [М п +] - при-поверхнева концентрація іонів металу. Т-абс. т-ра, R-газова стала. Однак, залишаючись рівноважним, потенціал змінюється, тому що [М n +] у пов-сті зростає пропорційно швидкості анодного розчинення (тобто щільності струму i). Соотв. залежність Е від i описується рівнянням:
де К - емпіріч. коефіцієнт. Це ур-ня м.б. порушено, коли буде досягнута межа р-рімості солі. утвореною металом з одним з аніонів електроліту. і [М] перестане рости. Якщо утворюється при цьому осад пухкий і помітно не перешкоджає проходженню струму, то далі метал стає практично неполярізуемим. Така, напр. природа неполярізуемості отрицат. пластини свинцевого акумулятора.
У водних розчинах електролітів поляризованість описаного концентрац. типу характерна для перехідних металів I і II груп (Ag, Cu, Zn, Cd), к-рим властиві високі значення iо. Її найважливіша особливість - залежність Е не тільки від i, але і від інтенсивності перемішування розчину.
При i> iо розчинення протікає з кинетич. контролем, тобто лімітується власне ЕлектроХіт. стадією - перенесенням зарядженої частинки через кордон метал-р-р, і його швидкість змінюється з потенціалом Е за законом:
де Т. наз. коеф. перенесення. Цей тип поляризуемости особливо характерний для перехідних металів VIII групи (Fe, Ni, Co і ін.), К-які відрізняються низькими значеннями iо.
На лімітуючу стадію, а значить, і на весь процес може сильно впливати попередня їй стадія адсорбционного і хім. взаємодій. поверхневих атомів металу з компонентами розчину (молекулами р-розчинника, анионами електроліту). З урахуванням цієї стадії механізм і швидкість анодного розчинення можна виразити таким чином:
де А - адсорбує компонент розчину, т-число його молекул. що беруть участь в процесі, К1 - константа. Залежно від умов адсорбція може стимулювати або пригнічувати анодне розчинення (т м. Б. Позитивним або негативним). Соотв. введення в р-р або видалення з нього адсорбирующихся компонентів - один з ефективних методів регулювання швидкості анодного розчинення в техніці. Стимулятори широко використовують в технології розмірної ЕлектроХіт. обробки металів. а також для зниження поляризуемости розчиняються анодів. Використання інгібіторів анодного розчинення - один з важливих методів захисту металів від корозії (див. Інгібітори корозії).
Анодне розчинення. кінцевими продуктами догрого є многовалентние катіони або їх комплекси, протікає, як правило, через ряд одноелектронних стадій (п - 1), кожна з яких брало в залежності від умов може виявитися лимитирующей. При цьому промежут. іони металу низьких ступенів окислення нерідко доокісляются до стійкого стану не тільки (а іноді не стільки) електрохімічних, але і в результаті безпосереднього взаємодій. з окислить. компонентою розчину (молекули розчиненого кисню. іони Н +), напр. по р-ції:
У подібних випадках підсумкова швидкість анодного розчинення може значно перевищувати величину, розраховану тільки по току.
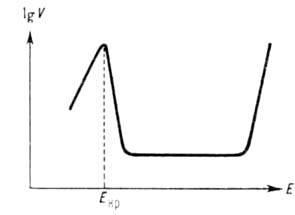
Нерідко анодне розчинення ускладнюється вторинними явищами. Так, освіту на пов-сті розчиняється металу фазових або адсорбційних сольових або оксидних шарів призводить до пасивації анодного розчинення (див. Пасивність металів), к-раю проявляється в ослабленні залежності його швидкості від потенціалу, в досягненні граничної щільності струму розчинення. а іноді і в зміні типу залежності. У водних середовищах покращення. схильністю до пасивації відрізняються мн. перехідні метали (Mo, Cr, Ni, Fe і ін.). Для них характерний критич. потенціал Екр. залежить від природи металу і рН розчину. При досягненні Екр звичайне збільшення швидкості анодного розчинення змінюється її різким зниженням, іноді до дек. порядків величини. Після цього у великому інтервалі значень потенціалу швидкість анодного розчинення зберігається постійною, а потім знову починає експоненціально зростати з потенціалом (див. Рис.). Останнє явище, відоме як перепассівація, обумовлено новим анодним процесом (окисленням металу до іонів вищої валентності), к-рий лежить в основі ЕлектроХіт. технології отримання вищих кисневих соед. ряду металів. напр. Mn, Cr. При анодному розчиненні сплаву можливий нерівномірний перехід його компонентів в р-р, тобто виборче розчинення одних компонентів і збагачення поверхневого шару металу іншими.
===
Ісп. література для статті «анодного розчинення». Колотиркін Я. М. "Природа", 1979, № 11, с. 2-13: його ж, ".захисту металів", 1983, т. 19, № 5, с. 675-85; Основи теорії і практики електрохімічної обробки металів і сплавів. М. 1981. Я.М. Колотиркін.