Загальні механізми розвитку серцевої недостатності
Міокардіальна форма серцевої недостатності характеризується зниженням розвивається серцем напруги. Це проявляється падінням сили і швидкості його скорочення і розслаблення.
Перевантажувальна форма серцевої недостатності формується на тлі більш-менш тривалого періоду його гіперфункції. Останнє в кінці кінців призводить до зниження сили і швидкості скорочення і розслаблення серця.
В обох випадках (і при перевантаженні, і при пошкодженні серця) зниження його скорочувальної функції супроводжується включенням екстра-та інтракардіальних механізмів компенсації цього зсуву. Всі вони, незважаючи на відоме своєрідність, в умовах цілісного організму взаємопов'язані таким чином, що активація одного з них суттєво впливає на реалізацію іншого.
Механізмиекстреннойкомпенсаціісократітельнойфункціі
Механізми екстреної компенсації зниженою скорочувальної функції серця наведені на рис. 22-25.

Мал. 22-25. Екстрені механізми компенсації зниженою скорочувальної функції серця.
• Підвищення скоротливості міокарда при його розтягуванні притекающей кров'ю (механізм Франка -Старлінга). Забезпечує збільшення розвивається міокардом напруги і швидкості скорочення і розслаблення.
† Збільшення напруги, що розвивається серцем, здійснюється у відповідь на зростаюче розтягнення міокарда. У зв'язку з цим механізм Франка -Старлінга називають Гетерометричний, тобто пов'язаним зі зростанням довжини м'язового волокна.
† Збільшення швидкості скорочення і розслаблення кардіоміоцитів розвивається в зв'язку з більш швидким викидом Ca 2+ з кальцієвих депо (саркоплазматичного мережу) і подальшим прискореним закачуванням Ca 2+ (Са 2+ -АТФази) в цистерни саркоплазматической мережі.
• Збільшення сили скорочень міокарда у відповідь на підвищене навантаження. Відбувається при незмінній довжині міоцитів. Такий механізм називають гомеометрической, оскільки він реалізується без значної зміни довжини м'язових волокон.
• Зростання скоротливості серця при збільшенні ЧСС.
• Підвищення скоротливості серця в результаті зростання симпатикоадреналових впливів. Характеризується збільшенням частоти і сили скорочень.
† Симпатична іннервація міокарда здійснюється закінченнями аксонів адренергічних нейронів шийного верхнього, шийного середнього і зірчастого (шийно-грудного) гангліїв.
† Активація симпатичних нервів викликає позитивний інотропний ефект. Збільшується частота спонтанної деполяризації мембран водіїв ритму, полегшується проведення імпульсу в волокнах Пуркіньє. збільшується частота і сила скорочення типових кардіоміоцитів.
† Дія катехоламінів на кардіоміоцити через 1 -адренорецептори обумовлено рядом наступних подій: стимуляція -адренорецепторів адреномиметиком (наприклад, норадреналіном) через G-білок активується аденилатциклаза з утворенням цАМФ активація цАМФ-залежної протеїнкінази фосфорилювання білка р27 сарколемми в саркоплазму збільшується вхід кальцію через відкриті потенціалозавісімие Ca 2+ -канали посилюється кальцій-індукована мобілізація Ca 2+ в цитозоль через активовані рецептори ріанодину в сар коплазме значно підвищується концентрація Ca 2+ зв'язування Ca 2+ з тропонином C знімає інгібуючу дію тропомиозина на взаємодію актину з міозином утворюється більша кількість актомиозинового зв'язків збільшується сила скорочення.
Компенсаторнаягіперфункціясердца
Функціонування названих вище механізмів забезпечує екстрену компенсацію скорочувальної функції перевантаженого або пошкодженого міокарда. Це супроводжується значним і більш-менш тривалим збільшенням інтенсивності функціонування серця - його компенсаторною гіперфункцією.
Компенсаторнаягіпертрофіясердца
Гіперфункція міокарда обумовлює експресію окремих генів кардіоміоцитів. Вона проявляється збільшенням інтенсивності синтезу нуклеїнових кислот і білків. Прискорення синтезу нуклеїнових кислот і білків міокарда призводить до наростання його маси - гіпертрофії. Біологічне значення компенсаторною гіпертрофії серця полягає в тому, що збільшена функція органу виконується його зрослої масою.
Механізмидекомпенсаціігіпертрофірованногосердца
Потенційні можливості гіпертрофованого міокарда та збільшувати силу і швидкість скорочення не безмежні. Якщо на серце продовжує діяти підвищене навантаження або воно додатково пошкоджується, сила і швидкість його скорочень падають, а їх енергетична «вартість» зростає: розвивається декомпенсація гіпертрофованого серця.
Механізми декомпенсації гіпертрофованого серця перераховані на рис. 22-26.
Мал. 22-26. Основні механізми декомпенсації гіпертрофованого серця.
В основі декомпенсації тривало гіпертрофованого міокарда лежить порушення збалансованості зростання різних його структур. Ці зрушення - поряд з іншими (див. Рис 22-26) - в кінцевому рахунку зумовлює зменшення сили серцевих скорочень і швидкості контрактильного процесу, тобто - розвиток серцевої недостатності.
Клітинно-молекулярниемеханізмисердечнойнедостаточності
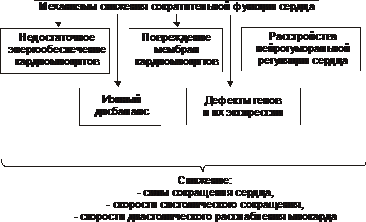
Зниження скоротливої функції серця є підсумком розвитку серцевої недостатності самої різної етіології. Незважаючи на відмінність причин і відоме своєрідність початкових ланок патогенезу серцевої недостатності, її механізми на клітинному і молекулярному рівні єдині. Головні з цих механізмів наведені на рис. 22-27.

Мал. 22-27. Основні механізми зниження скорочувальної функції міокарда при серцевій недостатності.
• Недостатність енергетичного забезпечення клітин міокарда
Розлад енергопостачання основних процесів, що відбуваються в клітинах міокарда (перш за все його скорочення і розслаблення), розвивається внаслідок порушення: ресинтезу макроергів, транспорту їх енергії до еффекторним структурам кардіоміоцитів, утилізації ними енергії макроергічних фосфатних сполук. Ці ланки патогенезу в загальному вигляді розглянуті в розділі 4 «Патологія клітини» (розділ «Загальні механізми пошкодження», підрозділ «Розлади енергетичного забезпечення клітини»).
Порушення забезпечення кардіоміоцитів енергією на етапах її продукції, транспорту та утилізації може бути як стартовим механізмом зниження скорочувальної функції серця, так і істотним фактором наростання її депресії.
• Пошкодження мембран і ферментів кардіоміоцитів
Пошкодження клітинних мембран і ферментів розглянуто в розділі 4 «Патологія клітини» (розділ «Загальні механізми пошкодження», підрозділ «Пошкодження мембран і ферментів»).
Альтерація мембран і ферментів клітин міокарда - головне, а нерідко і ініціальні ланка патогенезу серцевої недостатності. Зміна фізико-хімічних властивостей і конформації молекул білка (структурних і ферментів), ліпідів, фосфоліпідів і ЛП супроводжується значним оборотним, а часто - необоротним пошкодженням структури і функції мембран і ферментів, в тому числі - мітохондрій, саркоплазматичного ретикулума, міофібрил, плазматичноїмембрани, забезпечують реалізацію скорочувальної і ритмічною функцій серця.
Порушення змісту і співвідношення між окремими іонами всередині і поза клітинами розглянуті в розділі 4 «Патологія клітини» (розділ «Загальні механізми пошкодження», підрозділ «Дисбаланс іонів і води в клітці»). Нижче наведені специфічні для розвитку серцевої недостатності особливості іонного дисбалансу.
Іонний дисбаланс при серцевій недостатності проявляється порушенням співвідношення між окремими іонами в різних секторах кардіоміоцитів: в органелах (мітохондріях, саркоплазматическом ретикулуме, миофибриллах), в цитоплазмі, по різні боки плазматичноїмембрани кардіоміоцитів. Найбільшою мірою це відноситься до іонів: K +. Na +. Ca 2+. Саме ці катіони в основному визначають реалізацію таких процесів, як збудження, електромеханічне спряження, скорочення і розслаблення міокарда.
• Порушення в генетичної програм кардіоміоцитів
Порушення в генетичній програмі клітин і / або механізмів її реалізації розглянуті в розділі 4 «Патологія клітини» (розділ «Загальні механізми пошкодження», підрозділ «Генетичні порушення»).
При серцевої недостатності відбувається активація генів, що контролюють процеси відновлення субклітинних структур кардіоміоцитів, а також зростання судин мікроциркуляторного русла і нервових волокон. Зокрема, при ішемічному і стресорному пошкодженні серця пригнічена експресія мРНК, для Ca 2+ -залежною АТФази саркоплазматической мережі. Це і потенціює пригнічення процесів захоплення і викиду Ca 2+ ретикулумом міоцитів. В умовах ішемії та інфаркту міокарда, хронічного емоційно-больового стресу пригнічений також процес трансляції генетичної інформації. Це супроводжується порушенням синтезу різних білків клітин міокарда.
• Розлади нейрогуморальної регуляції серця
Загальна характеристика порушень регуляції клітинних функцій приведена в розділі 4 «Патологія клітини» (розділ «Загальні механізми пошкодження», підрозділ «Розлади регуляції внутрішньоклітинних процесів»). Нижче розглянуті важливі для розвитку серцевої недостатності зміни симпатичної і парасимпатичної регуляції серця.
† Зміна механізмів симпатичної регуляції.
‡ Зменшення вмісту нейромедіатора симпатичної нервової системи - норадреналіну в тканини серця.
Причини. Зниження синтезу норадреналіну в нейронах симпатичної нервової системи (в нормі в них утворюється близько 80% медіатора, що міститься в міокарді). Є результатом придушення активності фермент тирозин гідроксилази і гальмування захоплення норадреналіну нервовими закінченнями.
‡ Зниження адренореактівних властивостей серця, тобто вираженості іно, хроно-, дромо- і батмотропний ефектів норадреналіну і адреналіну.
† Зміна механізмів парасимпатичної регуляції.
‡ Ацетилхолин через м-холінорецептори викликає зменшення частоти серцевих скорочень, пригнічуючи утворення цАМФ і активуючи освіту цГМФ. цГМФ активує цГМФ-залежну киназу, переважну активність потенціалозавісімих Ca 2+ -каналів.
‡ Зміна механізмів парасимпатичної регуляції при серцевій недостатності виражені значно менше, ніж симпатичної. Це є результатом більш високої резистентності парасимпатических механізмів до різних пошкоджень факторами.
Наслідки порушених симпатичних і парасимпатичних впливів на міокард складаються в зниженні ступеня керованості і надійності регуляції серця. Це призводить до падіння темпу і величини мобілізації скорочувальної функції серця, особливо в надзвичайних умовах.