Випромінювання і поглинання енергії атомами і молекулами - студопедія
У 1913 році Бором запропонована теорія випромінювання світла, яка ґрунтується на двох постулатах:
1. Внутрішня енергія атома дискретна, тобто може приймати тільки певні дозволені значення або рівні, кратні характерним для даного атома кількостей, або квантам енергії. Стану атома, що відповідають цим рівням енергії, є стаціонарними: в такому стані атом не випромінює електромагнітних хвиль, не дивлячись на те, що відбувається в ньому рух електронів.
2. Випромінювання (або поглинання) електромагнітного випромінювання відбувається при переході атома з одного стаціонарного стану в інший. При цьому випускається (або поглинається) фотон монохроматичноговипромінювання з енергією, що дорівнює різниці енергій енергетичних рівнів Еm і En:
де Em і En - енергія системи в першому і другому станах, h - постійна Планка, n - частота випромінюваної хвилі ..
На основі цих постулатів Бор розробив теорію випромінювання і поглинання енергії світла атомом водню. Він припустив, що з усіх можливих орбіт електрона здійснюються тільки ті, для яких момент імпульсу (момент кількості рухів) дорівнює цілому кратному постійної Планка, поділеній на 2p:
Число n. називається головним квантовим числом, відповідає порядковому номеру орбіти.v - швидкість руху електрона по стаціонарній орбіті.
У разі атома водню кулоновская сила взаємного тяжіння протона і електрона є доцентровою силою, що утримує електрон на орбіті, тобто:
де m і е - маса і заряд електрона, r - радіус орбіти.
Виключаючи v з (1.1) і (1.2), отримаємо, що радіус електронних орбіт в атомі може приймати лише ряд дискретних значень:
з (1) підставляємо в (1.2) звідки. (N = 1, 2, 3.).
Таким чином, радіуси стаціонарних орбіт атома водню прямо пропорційні квадрату квантового числа n 2.
Для першої, основної, орбіти n = 1 і радіус.
З розглянутих співвідношень знаходиться і швидкість руху електрона по стаціонарній орбіті. Для основної орбіти атома водню (n = 1): 2,3 × 10 8 см / сек. Такий порядок швидкості руху електронів по орбіті.
Енергетичний рівень атома обумовлений повною енергією електрона, яка складається з кінетичної енергії електрона (ядро нерухомо) і енергії взаємодії електрона з ядром (потенційної енергії). Потенційна енергія електрона (по знаку вона негативна як потенційна енергія сил тяжіння) дорівнює:
Повна внутрішня енергія:
Таким чином, енергія електрона, пов'язаного в атомі з ядром, негативна. Енергія вільного електрона дорівнює нулю.
Підставляючи в це вираження значення швидкості електрона, знаходимо:
Для атома водню виходять такі значення:
основний (нульовий) рівень, n = 1, Е1 = - 13,55 еВ;
Схема енергетичних рівнів атома водню представлена на малюнку.
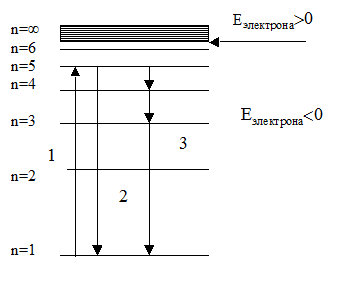
Мал. 1.1. Структура енергетичних рівнів атома водню.
Оскільки енергетичні рівні обернено пропорційні квадрату квантового числа n 2. різниця між кожними двома сусідніми рівнями в міру зростання числа і по абсолютній величині зменшується. Таким чином, у міру віддалення від ядра різниця між двома сусідніми енергетичними рівнями атома убуває:
Стаціонарний рівень з найменшою енергією називається основним, він відповідає стану атома, що не піддається ніяким зовнішнім впливам. Решта стаціонарні рівні називаються збудженими.
Порушення атома, тобто перехід електрона на орбіту більшого радіусу (Рис. 1.1. Перехід 1), вимагає повідомлення атому додаткової енергії і, отже, відбувається в результаті будь-яких зовнішніх впливів, наприклад, при зіткненні частинок в процесі інтенсивного теплового руху або при електричному розряді в газах, при поглинанні фотона електромагнітного випромінювання, в результаті рекомбінації іонів в газі або електронів і дірок в напівпровіднику, при впливі на атом частинок радіоактивного випромінювання і т.д. Збуджений стан нестійкий, приблизно через 10 -8 сек електрон повертається на основну орбіту, при цьому випромінюється фотон, що відносить додаткову енергію, отриману при порушенні, і атом, переходить в основний стан (Рис.1.1. Перехід 2).
Електрон може повертатися на основну орбіту не тільки єдиним переходом, але і сходинками через проміжні рівні. В цьому випадку при переході випромінюватиметься кілька фотонів (Рис. 1.1. Перехід 3) з частотами, відповідними різниці енергій цих рівнів.
Теорія Бора пояснювала серіальні закономірності спектра атома водню і водородоподобних атомів. Свого часу теорія була тріумфом розвитку атомної фізики. Однак, ця теорія не пояснює відмінності інтенсивностей спектральних ліній, не розкриває закономірностей більш складних атомів. Основний недолік теорії - її непослідовність. Вона об'єднує в собі положення принципово відмінних теорій: класичної та квантової. Так, відповідно до теорії, електрон рухається по круговій орбіті навколо ядра, що відповідає уявленням класичної фізики. Надалі теорія Бора була замінена квантовою механікою.
Залежність величини випромінюваної атомами або молекулами енергії від довжини хвилі або частоти світлової хвилі називається спектром випускання. а що поглинається - спектром поглинання. Інтенсивність спектральних ліній визначається числом однакових переходів, що відбуваються в одиницю часу, і тому залежить від кількості випромінюючих (поглинаючих) атомів і ймовірності відповідного переходу.
Атомними спектрами називають як спектри випускання, так і спектри поглинання, які виникають при квантових переходах між рівнями вільних або слабо взаємодіючих атомів. Атомні спектри є лінійчатими.
Під оптичними атомними спектрами розуміють ті, які обумовлені переходами між рівнями зовнішніх електронів з енергією фотонів порядку декількох електрон-вольт. Сюди відносяться УФ, видима і близька ІК (до мкм) області спектра. В спектрі випромінювання атома водню можна виділити кілька серій. Кожна серія відповідає переходам з різних рівнів на один і той же кінцевий.
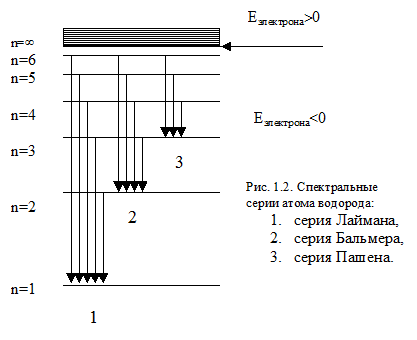
Спектральні лінії (частоти) цих серій можна розрахувати за формулою:
Серія Лаймана розташована в ультрафіолетовій області та утворюється при переходах електронів з верхніх енергетичних рівнів (ni = 2, 3, 4 ...) на нульовий рівень (n = 1).
Серія Бальмера розташована в видимої і близької ультрафіолетової областях, а серія Пашена - в інфрачервоній області.
Структура енергетичних рівнів складних атомів ускладнюється розщепленням електронних рівнів, залежних від взаємодії електронів між собою і ядром. Спектри подібних атомів смугасті.
1.2. Основні поняття квантової теорії.
В сучасної квантової теорії положення електрона в атомі не пов'язують з будь-якої орбітою, т. Е. Не встановлюють точного положення електронів в обсязі атома, а розглядають ймовірність знаходження електрона в тому чи іншому місці обсягу. Заряд електрона розподілений по всьому об'єму атома, утворити електронну хмару змінної щільності. Щільність електронної хмари в будь-якій точці об'єму атома відповідає ймовірності знаходження електрона в цій точці.
У квантовій механіці стан руху електронів в атомі характеризується не одним, а чотирма квантовими числами:
- Головне квантове число n приймає тільки цілочисельні значення від 1 до нескінченності.
- Побічна (або орбітальне) квантове число l приймає значення від 0 до (n-1) (всього n значень).
- Магнітне квантове число ml приймає цілочисельні значення від -l до + l, включаючи 0 (всього (2l + 1) значень).
- Спіновий квантове число ms може мати тільки два напівцілий значення: + ½ і -½.
Квантові числа визначають можливі енергетичні стану електронів в атомі. Кожен електрон характеризується певним набором квантових чисел. Сукупність електронів, що характеризуються одним головним квантовим числом утворює енергетичний рівень атома. Розподіл електронів в атомі по енергетичних рівнях здійснюється на основі принципів:
- Принцип Паулі. В атомі не може бути електронів, що характеризуються однаковим набором квантових чисел.
- Принцип мінімуму енергії. Розподіл електронів в атомі відповідає мінімуму енергії атома.