Вимірювання електродного потенціалу

Головна | Про нас | Зворотній зв'язок
В даний час немає методів з вимірювання абсолютного значення потенціалу окремого електрода, але може бути визначена умовна кількісна величина електродного потенціалу по відношенню до будь-якого іншого електрода, яка була обрана в якості електрода порівняння.
Як електрод порівняння був вибраний і використовується зараз стандартний водневий електрод.
Такий електрод містить платинову фольгу, занурену в розчин, що містить іони водню і який постійно омивається газоподібним воднем. Газоподібний водень має тиск 1 атмосфери і активність іонів водню в розчині дорівнює 1 (, (упрощенно- коли концентрація = 1).
Наступна реакція відбувається на водневому електроді:
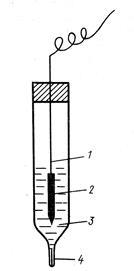
1-розчин, що містить Н + -іони (aH + = 1),
2 електролітичний ключ (сольовий місток),
3-електрод, потенціал якого вимірюється,
4 електролітичний ключ (трубка з розчином електроліту)
Електродний потенціал дорівнює ЕРС гальванічного елемента, який складається з даного електрода і стандартного водневого електрода
Якщо правильно його використовувати, водневий електрод може давати дуже точні результати, відтворювані до 0.00001В. Але його велика чутливість (залежність) до зовнішніх умов сильно перешкоджає його використанню, тому інший більш стабільний електрод з точно відомим електродним потенціалом використовується в якості порівняння замість водневого електрода. Один з таких найбільш поширених - хлор-срібний електрод, який представляє собою срібну зволікання, покриту AgCl і занурену в розчин KCl (найчастіше - насичений).
1 срібна зволікання,
2 - хлорид срібла,
4 - електролітичний ключ (капіляр, заповнений пористим інертним
речовиною, просочений розчином KCl)
Гальванічний елемент складається з 2-х частин, кожна з яких містить один електрод. Змінюючи одну з частин можна створювати дуже різні гальванічні елементи.
Електрорушійна сила гальванічного елемента (е.р.с.) це максимальне значення різниці потенціалів між електродами:
гдe jc - потенціал катода,
ja - потенціал анода.
Окислення має місце на аноді і відновлення - на катоді.
Приклад запису гальванічного елемента, що містить Zn електрод в розчині ZnSO4 і Cu електрод в розчині CuSO4:
(-) Zn çZn 2+ ççCu 2+ çCu (+)
(-) Zn çZnSO4 ççCuSO4 çCu (+)
Zn çZn 2+ означає стрибок потенціалу на кордоні метал-розчин іонів металу
ZnSO4 ççCuSO4 показує дифузний стрибок електродного потенціалу між двома розчинами.
Дифузійним потенціалом називається різниця потенціалів, що виникає на поверхні розділу між 2-ма розчинами, які відрізняються або по виду розчиненої речовини чи по його концентрації.
Максимальна корисна робота гальванічного елемента. При оборотному проведенні будь-якої реакції, що проходить при постійній температурі і тиску отримується від неї робота буде максимальною роботою реакції А'max. Робота, що здійснюється гальванічним елементом в цих умовах дорівнює ЕРС елемента помножена на кількість минулого електрики. Ми висловлюватиме кількості речовин які піддалися перетворенням в результаті реакцій в одиницях грам-атомів елемента (або грам-іонів для комплексних іонів). Кількість електрики, яке відповідає такому перетворенню (гр-ат або гр-іон) буде рівним ne × F кулонів,
гдe ne - заряд іона,
F = 96487 кулон / мoль (or Кл × мoль -1) - константа (число) Фарадея
(Фізичний зміст числа Фарадея - заряд 1грaмм-атом (або іон) речовини).
де W'max - позначення роботи в електрохімії.
b × B + d × D Û q × Q + r × R
E = - = = E o - ln
E = E o - ln - рівняння Нернста.
E o - ЕРС гальванічного елемента в стандартних умовах коли cB = cD = cQ = cR = 1
Величина E o - називається нормальної (або стандартної) ЕРС елемента.
Якщо взяти гальванічний елемент зі стандартним водневим електродом тоді потенціал металевого електрода дорівнює: j = j o + lncM
гдe j o - стандартний потенціал електрода - тобто потенціал, який виникає коли активність (концентрація) іонів металу дорівнює одиниці.
Розрахувати електродний потенціал різних металів в розчинах їх солей при різних концентраціях можна використовуючи рівняння Нернста і значення стандартних електродних потенціалів цих металів, які можна знайти в довідниках.
Стандартні електродні потенціали різних електродів можна розташувати в так званий ряд напруг - електрохімічний ряд активності металів (ряд стандартних електродних потенціалів) - послідовність, в якій метали розташовані в порядку збільшення їх стандартних електрохімічних потенціалів # 966; 0. відповідають полуреакции відновлення катіона металу Me n +:
Me n + + n # 275; → Me
Ряд напруг характеризує порівняльну активність металів в окисно-відновних реакціях у водних розчинах.
У міжнародному союзі ІЮПАК (Union Pure and Applied Chemistry) прийнято, що потенціал металів, які по відношенню до стандартного водневого електроду є негативними, записуються зі знаком "мінус" перед їх значенням. Якщо метал по відношенню до стандартного водневого електроду - позитивний, то його значення записується зі знаком плюс.
Поляризація - це відхилення потенціалів електроду від його рівноважного значення при проходженні електричного струму. Поляризація зменшує ЕРС гальванічного елемента і швидкість електролізу.
Концентраційна поляризація відбувається через зміну концентрації іонів поблизу поверхні електродів в результаті електрохімічної реакції:
Концентрація Zn 2+ -іонів зростає
Концентрація Cu 2+ -іонів зменшується
Хімічна поляризація відбувається через зміну стану (природи) поверхні електрода під дією продуктів електрохімічної реакції (утворення речовин на поверхні електрода, які перешкоджають електрохімічної реакції):
2H + + 2e ® H2 - (покриває поверхню електрода)
Реакція може змінити металевий електрод на "водневий" (наприклад, мідний електрод можна "перетворити" в водневий)
Dj = j o H2 - j o Cu = - 0.337 V
Обидва типи поляризації можуть бути зменшені різними способами, які називаються деполяризацией.
Концентраційна поляризація може бути значно зменшена інтенсивним перемішуванням розчину. Хімічна поляризація може бути зменшена додаванням речовин, які будуть реагувати з тими речовинами, які викликали поляризацію. Наприклад, в якості деполяризатора для реакції, в результаті якої виділяється газоподібний водень, можна застосувати перекис водню і знизити деполяризацию: