електродний потенціал
Електродний потенціал виникає на кордоні доторкніться-нення металу з рідиною, наприклад з водою або водним рас-твором солі цього металу. Умовне позначення такої системи М z + / М, де М z + - потенціалопределяющего катіони металу (окислена форма), риса відзначає наявність кордону розділу розчин - тверда фаза, М - метал (відновлена форма).
Розглянемо процеси, що протікають при зануренні ме-талію в воду. Між катіонами металевої решітки на по-поверхні металу і диполями води виникають сили електростатичного іон-дипольної взаємодії. Ті катіони, ки-генетичних енергія теплового руху яких досить велика, внаслідок гідратації відриваються від поверхні металу і ...
переходять в воду (реакція окислення). При цьому ме-талл заряджається негативно за рахунок надлишку електронів, що залишилися, а вода - позитивно за рахунок перейшли в неї катіонів металу. Зрозуміло, процес переходу катіонів в по-ду супроводжується і зворотним процесом - переходом дегідро-тірован катіонів металу з отриманого водного розчину на поверхню металу (реакція відновлення). В цілому цей окислювально-відновний процес може бути виражений рівнянням:
При зануренні металу в чисту воду в початковий мо-мент часу швидкість виходу катіонів максимальна, а швидкість їх входу мінімальна, тому Принаймні перебігу процесу окислення швидкість виходу катіонів металу зменшується, а швидкість їх входу в тверду фазу збільшується в результаті виникнення ДЕС і взаємодії з ним іонів. Через деякий час швидкості виходу і входу катіонів вирівню-ються і в системі встановлюється рівноважний ДЕС, в якому поверхня металу заряджена негативно, а розчин - позитивно (рис. 25.1, а). Сталий ДЕС харак-теризують рівноважним електродним потенціалом.
Якщо метал занурити не в чисту воду, а в водний розчин його солі, то в залежності від природи металу та концентрації (активності) його іонів в розчині можливо, що на початку швидкість переходу катіонів металу в розчин буде менше, ніж швидкість їх осадження на поверхні металу, т. е. у цьому випадку внаслідок первісного переваги самопроіз-вільного відновлення катіонів металу виникає равновес-ний ДЕС, в якому метал заряджений позитивно, а розчин-негативних (рис. 25.1, б).
Отже, в результаті переходу катіонів металу че-рез поверхню розділу метал - розчин завжди утворюється ДЕС і виникає електродний потенціал. Величина електрод-ного потенціалу ф (М z + / М), що виникає на межі метал -розчин, залежить від наступних факторів:
- природи металу (енергії його кристалічної решітки, енергії іонізації атомів металу і енергії гідратації його ка-тионов);
- активності (ефективної концентрації) потенциалопределяющих іонів в розчині;
- температури розчину.
Потенціал, що виникає в системі при стандартних умо-вах, називається стандартним і позначається ф ° (М z + / М).
Стандартним електродним потенціаломназивает-ся потенціал, що виникає на межі метал - рас-твор при активності потенциалопределяющих іонів в розчині 1 моль / л і температурі 298 К.
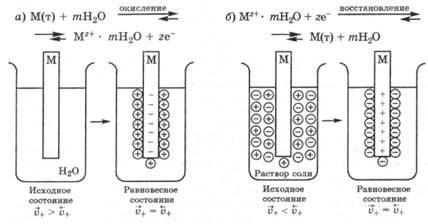
Мал. 25.1. Виникнення електроднихпотенціалів:
а - при зануренні металу в чисту воду; б - при зануренні ме-талію в розчин його солі
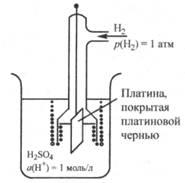
Мал. 25.2. Стандартний водневий електрод
Абсолютне значення стандартно-го електродного потенціалу окремо взятого електрода виміряти або рас-вважати неможливо, але можна визна-ділити його значення щодо будь-якого електрода, обраного в якості еталону. Згідно з Міжнародною угодою таким ця-лоном служить стандартний водо-родний електрод.
В електрохімії використовується шкала стандартних потенціалів, визначених щодо потенціалу стандартного водневого електрода, значення якого умовно прийнято рівним нулю.
Стандартний водневий електрод являє собою пла-тинів пластинку, покриту платинової черню (пухкої пла-тванню) і опущену в розчин кислоти, в якому активність іонів водню дорівнює 1 моль / л і через який весь час пропускається дуже чистий газоподібний водень під тиском 1 атм ( 101 325 Па) (рис. 25.2).
Умовне позначення стандартного водневого електрода:
На водневому електроді протікають оборотні процеси:
Потенціал стандартного водневого електрода умовно прийнятий за нуль при будь-якій температурі:
Слід зазначити, що водневий електрод не дуже зручний в роботі, але важливий в термодинамічній відношенні, оскільки він служить первинним стандартом, щодо якого визна-ються потенціали інших електродів. На практиці замість водневого електрода в якості електрода порівняння широко використовують хлорсеребряного електрод, пристрій і робота кото-рого будуть розглянуті в розд. 25.6.
Для визначення електродного потенціалу будь-якого електрода щодо стандартного водневого складають Гальве-нічних ланцюг (елемент) з двох напівелементів: досліджуваного електрода і стандартного водневого електрода.
Гальванічна ланцюг являє собою замкнуту систе-му, що складається з двох електродів, з'єднаних між собою зовнішньої ланцюгом - електронний провідник (метал) і внут-ній ланцюгом - іонний провідник (розчини електроліту, соеди-ненние сольовим містком). У гальванічної ланцюга відбувається перетворення хімічної енергії процесів окислення і відновлення в електричну енергію. У гальванічної ланцюга розрізняють електроди: анод і катод.
Анодомв електрохімії називається електрод, на ко-тором протікає реакція окислення, т. Е. Віддача елек-тронів.
У гальванічної ланцюга анод заряджений негативно, і він посилає електрони в зовнішній ланцюг. Анодом завжди є електрод, матеріал якого легше окислюється, наприклад активніший метал. На відміну від анода, анодний розчин через на-копления в ньому надлишку катіонів заряджається позитивно.
Катодомв електрохімії називається електрод, на ко-тором протікає реакція відновлення, т. Е. Присое-динение електронів.
У гальванічної ланцюга катод заряджений позитивно, і він отримує електрони із зовнішнього ланцюга. Катодом є елек-Трод з менш активного металу, катіони якого легше відновлюються. На відміну від катода, катодний розчин в галь-ваніческой ланцюга заряджається негативно через накопичення в ньому аніонів.
Необхідно завжди пам'ятати, що при розгляді електро-лізу (коли електрична енергія перетворюється в хімічну) характер процесів, що протікають на електродах, зберігається, а знаки анода і катода змінюються на протилежні.
При умовному позначенні гальванічної ланцюга анод запи-Сива зліва, катод справа. Кордон розділу між електродом і розчином, в який він опущений, позначається однією рисою, а електролітичний місток, що з'єднує анодний і катодний розчини, позначається двома рисами:
При замиканні гальванічної ланцюга в ній через простору-ного поділу реакцій окиснення (анод) і відновлення процесів-ня (катод) відбувається спрямований рух електронів від анода до катода по зовнішньому ланцюзі, а іонів - по внутрішньої ланцюга (електролітичному містку). Внаслідок виникнення на-правленного руху заряджених частинок в гальванічної ланцюга має місце перетворення хімічної енергії окисли-кові-відновних реакцій в електричну. Таким об-разом, гальванічні ланцюга можуть бути хімічними источни-ками струму.
Здатність гальванічної ланцюга до переносу електричних зарядів характеризується електрорушійної силою (ЕРС).
ЕРС гальванічного цепіопределяется як різниця потенціалів катода і анода: Е = фк - фа.
У гальванічної ланцюга, що працює мимовільно, пітний-циал анода завжди менше потенціалу катода, і її ЕРС - вели-чину позитивна (Е> 0).
Вимірювання електродних потенціалів. Якщо виміряти ЕРС гальванічного ланцюга, складеної з досліджуваного електрода і стандартного водневого, то можна визначити значення елек-тродного потенціалу досліджуваного електрода.
Значення електродного потенціалу чисельно дорівнює ЕРС гальванічного ланцюга, складеної з стандартного по-огрядного електрода і електрода, потенціал якого підлягає визначенню і має знак "+", якщо на ньому протікає процес відновлення, і знак "-", якщо процес окислення.
Розглянемо конкретні приклади. Визначимо значення стан-дартного потенціалу цинкового електрода, опущеного в розчин солі цинку, в якому активність катіонів a (Zn 2+) = 1 моль / л. Оскільки цинк окислюється легше, ніж водень, то в гальвані-чеський ланцюга цинковий електрод буде анодом, а стандартний водневий електрод - катодом (рис. 25.3).
Запишемо схему складеної гальванічної ланцюга:
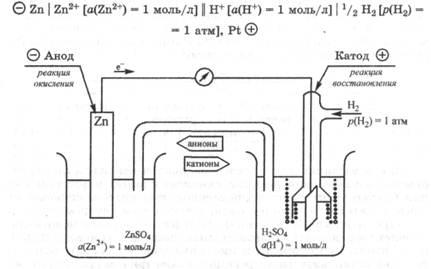
Мал. 25.3. Гальванічна ланцюг для вимірювання стандартного електро-тродного потенціалу цинкового електрода
ЕРС цієї гальванічної ланцюга дорівнює різниці потенціалів катода і анода:
Визначимо стандартний потенціал мідного електрода, якщо ЕРС гальванічного ланцюга, складеної з обумовленого електрода і стандартного водневого, дорівнює 0,34 В.
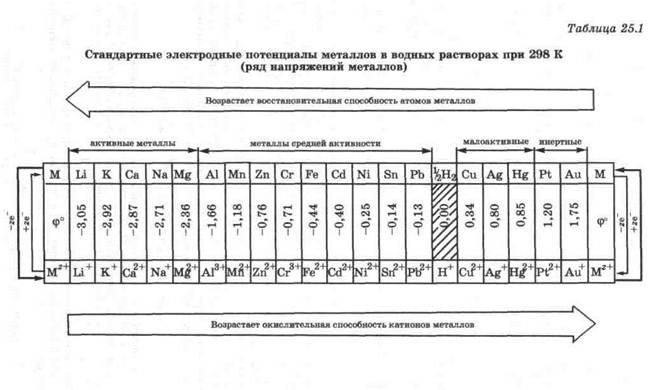
Величина стандартного електродного потенціалу металу ха-рактерізует його здатність віддавати електрони і має посто-янное для кожного металу значення. Стандартні електродні потенціали металів приведені в табл. 25.1.
Ряд напряженій- це розташування металів в по-рядку зростання їх стандартних електродних по-потенціалів.
В ряді напруг ті метали, які віддають електрони легше, ніж водень, стоять зліва від водню і мають негативного-ні значення стандартних електродних потенціалів. Ті метали, які віддають електрони важче, ніж водень, стоять праворуч від водню і мають позитивні значення стандартних елек-тродних потенціалів. Чим менше значення ф ° (М z + / М), тим ак-тивно метал.
Рівняння Нернста. Значення електродного потенціалу, мож-ника на кордоні метал - розчин, залежить від природи металу, активності його іонів в розчині і від температури. Вплив всіх перерахованих факторів на величину електрод-ного потенціалу металу виражається рівнянням Нернста:
де ф ° - стандартний електродний потенціал; R - універсальна газова стала, 8,31 Дж / (моль • К); Т - температура, К; г - заряд потен-ціалопределяющіх іонів металу; F - число Фарадея, 96 500 Кл / моль; а (М z +) - активність потенциалопределяющих іонів металу в розчині, моль / л.
Якщо ввести чисельні значення постійних R і F і перейти від натурального логарифма до десяткового, рівняння Нернста набуде вигляду: