Срібла галогеніди - хімічна енциклопедія 1
СРІБЛО галогенідів. фториди складу Ag2 F, AgF і AgF2 і ін. галогеніди складу AgX (див. табл.).
Геміфторід Ag2 F при нагр. вище 90 ° С і при розчиненні у воді розкладається з утворенням AgF і Ag; диамагнитен; м. б. отримано УФ опроміненням AgF. Фторид AgF гигроскопичен; добре розчин. в воді (172 г в 100 г при 20 ° С); в системі AgF-H2 O т-ра евтектики -14,2 ° С (37,5% по масі AgF); до 18,6 ° С в рівновазі з розчином (62,9% по масі AgF) знаходиться тетрагідрат AgF · 4H2 O (-1387,8 кДж / моль, -1145,6 кДж / моль), до 39,5 ° С (68,95% AgF) -дігідрат AgF · 2H2 O (-801,6 кДж / моль, - 669,9 кДж / моль), вище 39,5 ° С безводна сіль. Дифторид AgF2 розкладається водою з утворенням AgF, HF, О2 і домішки О3.
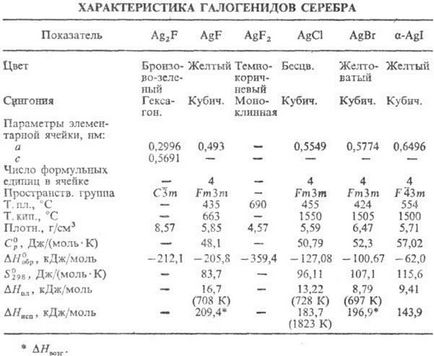
Хлорид (мінерал хлораргіріт, або кераргирит, рогова срібло) AgCl в газовій фазі перебуває у вигляді моно-, ді-і тримерного молекулу не розчин. в воді (твір р-ри-мости 1,8 · 10 -10), розчин. в конц. H N О3.
Бромід (мінерал бромаргіріт) AgBr до 259 ° С існує в кубич. кристаллич. модифікації, вище 259 ° С в ромбіч .; не розчин. в воді (твір р-рімості 5,4 x x 10 -13).
Йодид (мінерал іодаргіріт) Agl існує в дек. кристаллич. модифікаціях: до 136 ° С стійкий a -Agl, в інтервалі 136 - 147 ° С-гексагон. b-форма (а = 0,4596 нм, с = 0,7500 нм, z = 2, просторів. група Р 63 тс), вище 147 ° С-кубич. g -Модифікація; не розчин. в воді (твір р-рімості 8,5 · 10 -17), розчин. в етанолі.
С. р розчин. в надлишку відповідних галогеноводородами-них до-т з утворенням галогенідними комплексів, вони також розчин. в розчинах ціанідів та тиосульфатов лужних металів і водному аміаку з утворенням комплексних іонів Ag. С. р відновлюються до Ag неорг. (Pb, Zn, Mg, Н2) і орг. (Гідразин, формальдегід, гідрохінон і т.п.) відновниками. Під дією світла розкладаються з виділенням Ag °; світлочутливість AgF більше, ніж у AgCl.
С. р отримують взаємодій. Ag з галогенами в присутності. води, а також обробкою Ag конц. водними розчинами галогенові-огрядних к-т і обмінним взаємодій. між р-Рімой сіллю Ag і відповідним галогенідів металу.
Для регенерації Ag з разл. відходів використовується сплав С. р з карбонатами лужних металів. С. р (AgCl, AgBr, AgI) використовують для отримання светочувствіт. емульсій в произове кіно- і фотоматеріалів. З AgCl виготовляють елементи оптики для ІК спектрометрів, детектори космічних. випромінювань. AgBr-каталізатор при отриманні деяких карбонових кислот. AgF, AgI і подвійні іодіди лужних металів і Ag мають високу іонної провідністю в твердому стані і застосовуються для виготовлення твердих електролітів і датчиків. AgF використовують також як компонент люмінофорів і фторуючий агент в орг. синтезі, AgI-прі гальваніч. сріблення, для освіти штучні дощу і снігу з грозових хмар. П. М. Чукур.
===
Ісп. література для статті «СРІБЛО галогеніди». немає даних
Сторінка «СРІБЛО галогеніди» підготовлена за матеріалами хімічної енциклопедії.