молекула водню
На схемі показано утворення молекули водню. З двох 1s - орбіталей атомів водню виникають дві молекулярні орбіталі. Одна з них сигма-зв'язує σ1sсв. інша сигма-розпушуються σ1sразр. Зв'язує орбиталь має меншу енергію, ніж вихідні атомні орбіталі, а розпушуються більшою. Тому електрони переходять на зв'язує орбіталь - см. Малюнки 7 і 8.
2 H (1s1) → H2 [(σсв.1s) 2] - 435 кДж
Зменшення енергії при переході електронів з атомних на молекулярні орбіталі і робить можливим утворення хімічного зв'язку і, відповідно, молекули водню.
Рис.7 Освіта молекулярних орбіталей в молекулі водню
Рис.8. Освіта зв'язує орбіталі в молекулі водню
Метод МО дозволяє пояснити факт існування іона H2 +. При його утворенні єдиний електрон переходить з атомної орбіталі 1 s на зв'язує орбіталь σсв.1s, що енергетично вигідно і супроводжується виділенням енергії:
H (1s1) + H + → H2 + [(σсв.1s) 1] + 259 кДж
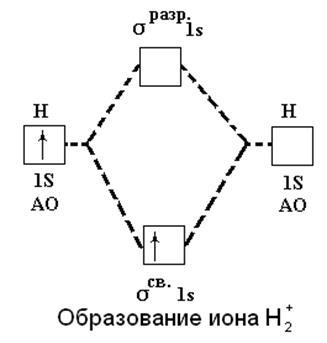
Рис.9. Освіта іона водню
Метод МО дозволяє пояснити і те, чому не можуть існувати деякі частинки. Наприклад, експериментально виявлений молекулярний іон He2 +. З трьох електронів, що входять до його складу, два займають зв'язує (σ1sсв.) 2 орбиталь, енергія якої менше, ніж у вихідних 1s орбіталей, і один розпушують σ1s разр, енергія якої більше вихідних 1s орбіталей. В результаті енергія молекулярного іона гелію виявляється менше, ніж сумарна енергія вихідних атома і іона гелію, що і визначає можливість його існування. Однак в молекулі гелію He2, якби така існувала, число електронів на зв'язує і розпушують орбиталях було б однаково і дорівнює двом. Тому енергетичного виграшу в порівнянні з сумарною енергією двох атомів гелію бути не може, саме тому молекул гелію не існує.