Методи отримання золів
Гідрофобні золі отримують 2-ма методами:
I метод диспергування або дисперсійний (дроблення);
II метод конденсації (укрупнення).
Методи диспергування здійснюються шляхом механічного, електричного або ультразвукового дроблення речовин до розмірів колоїдних частинок. Для цих цілей використовують спеціальні колоїдні млини.
Конденсаційні методи засновані на переході молекулярних і іонних розчинів в колоїдні шляхом утворення важкорозчинних речовин в результаті хімічних реакцій або зміни фізичних умов середовища.
До методів конденсації відносяться:
1) хімічні методи (гідроліз, реакція подвійного обміну, окислення-відновлення);
2) методи заміни розчинника, коли дисперсійнаСереда, в якій речовина дисперсною фази утворює молекулярний розчин, замінюється середовищем, в якій речовина нерастворимо.
Отримання золів методом хімічної конденсації
4 FeCl3 + 3 k4 [Fe (cn) 6] = Fe4 [Fe (cn) 6] 3 + 12 kCl
2) Гідроліз солі: FeCl3 + 3 H2 O = Fe (OH) 3 + 3 HCl
При отриманні золів методом хімічної конденсації дотримуються наступні умови:
1) золі отримують при змішуванні дуже розбавлених розчинів реагуючих речовин (наприклад, AgI), тому що при більш високій концентрації в еквівалентних кількостях утворюються опади;
2) для отримання золю необхідний стабілізатор. При хімічних методах отримання колоїдних систем в якості стабілізатора виступають продукти реакції.
Будова колоїдної міцели Розглянемо будову міцели AgI в надлишку ki:
Якщо одне з вихідних речовин взято в невеликому надлишку, то воно служить стабілізатором, тобто повідомляє стійкість колоїдних частинок AgI. Колоїдна частинка має складну структуру і складається з агрегату (сукупність великої кількості молекул). Іони I - будуть продовжувати добудовувати кристалічну решітку агрегату, повідомляючи йому електричний заряд. Цей іон називається потенціалопределяющего іоном (ПВІ). Потім починають адсорбироваться протівоіони К + (ПРИ). Основна частина всіх противоионов, адсорбована на ядрі колоїдної частинки, утворює разом з пої адсорбований шар, а частина протиіонів (10%) йдуть в об'єм розчинника і утворюють дифузний шар.
Схематично будову міцели AgI при надлишку KI виразиться так:
. n I~. (N - x) K +> x ˉ. x K +
агрегат пої при дифузний
Колоїдна частинка з дифузним шаром утворює міцели: m - число молекул йодиду срібла в ядрі
n - число потенциалопределяющих іонів I~
(N - x) - число пов'язаних противоионов До +. що входять в адсорбційний шар
х - число іонів К +. що входять в дифузний шар.
Коагуляція ліофобних золів
КОАГУЛЯЦІЯ - процес укрупнення колоїдних частинок за рахунок злипання під впливом молекулярних сил тяжіння.
Цьому процесу перешкоджає наявність у колоїдних частинок однойменного заряду. Щоб викликати коагуляцію золю, необхідно нейтралізувати заряд колоїдної частинки, тоді частинки будуть стикатися і злипатися. Коагуляцію золю можна викликати різними способами, найлегше за допомогою електролітів.
При коагуляції золів електролітами відбувається стиснення дифузного шару, що дозволяє колоїдних частинок підходити один до одного на відстань, на якому вже діють сили міжмолекулярної тяжіння.
Розрізняють 2 стадії коагуляції: приховану і явну. При явно коагуляції змінюється забарвлення золю за рахунок укрупнення частинок, з'являється каламуть, а далі відбувається седиментація - вільне осідання агрегатів колоїдних частинок під дією сили тяжіння.
Для настання явної коагуляції концентрація електроліту повинна бути дорівнює або більше порога коагуляції золю.
Коагулююча здатність електролітів характеризується ПОРОГОМ коагуляції (γс), тобто мінімальною концентрацією електроліту в мілімолях на 1 л золю, при якій починається явна коагуляція. Зворотній величина порога коагуляції називається коагулюючої дії (1 / γс).
Коагулююча дією володіє тільки той іон електроліту, який має заряд, протилежний заряду колоїдної частинки.
Наприклад, на позитивно заряджений золь заліза гідроксиду коагулююча дія надають аніони, а на негативно заряджений золь Fe4 [Fe (CN) 6] 3 (берлінської блакиті) - катіони.
Коагулююча здатність іона тим більше, чим вище його валентність.
ПРАВИЛО ШУЛЬЦЕ-ГАРДІ (правило значности) говорить: з 2-х іонів електроліту коагулююча дією володіє той, знак якого протилежний знаку заряду колоїдних частинок, причому ця дія тим сильніше, чим вище валентність коагулюючого іона.
Залежність між порогом коагуляції (γс) і валентністю (Z) коагулюючого іона виражається рівнянням:
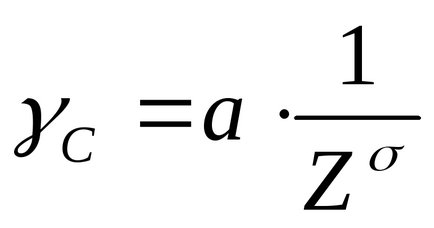
де γс - поріг коагуляції
а - коефіцієнт пропорційності.
За теорією Дєрягіна, поріг коагуляції змінюється обернено пропорційно валентності коагулюючого іона в шостого ступеня:
6. Питання для самоконтролю знань:
Записати формули міцел золів, отриманих при реакціях обміну:
а) при надлишку CaCl2;
Які іони електроліту-коагулятора будуть коагулировать даний золь: K +. Na +. Ca 2+. Cl~, Al 3+. [Fe (CN) 6] 3 ~, [Fe (CN) 6] 4 ~? Розташувати обрані іони в ліотропні ряди.
Визначте, до якого електроду повинні переміщатися частки золю, отриманого по реакції при невеликому надлишку H2 S: