квантові числа
Квантові характеристики електрона. Теорія Бора приписувала чотирьом електронним оболонок K, L, M і N квантове число і, рівне відповідно 1, 2, 3 і 4. Ці числа відповідають підвищується енергетичним рівням оболонок.
Однак уважний розгляд атомних спектрів показує, що лінії, обумовлені переходами між такими квантовими енергетичними рівнями, насправді розщеплені на більш тонкі лінії. Це вказує, що електронні оболонки в дійсності розщеплені на подоболочки, кожна зі своїм власним квантовим енергетичним рівнем. Електронні подоболочки отримали позначення за типами відповідних їм ліній в атомних спектрах, а саме:
s-подоболочка названа по «різкою» (sharp) s-лінії р-подоболочка названа по «головній» (principal) р-лінії d-подоболочка названа по «дифузійної» (diffuse) d-лінії f-подоболочка названа по «фундаментальної» (fundamental) f-лінії
s -подоболочки складається з однієї s-орбіталі. р -подоболочки складається з трьох р-орбіталей (див. рис. 1.18), а d-подоболочка-з п'яти d-орбіталей.
Лінії, обумовлені переходами між цими подоболочкі, відчувають подальше розщеплення, якщо атоми елементів поміщені в зовнішнє магнітне поле. Це розщеплення називається ефектом Зеемана. Експериментально встановлено, що вказане розщеплення можливо тільки для р-, d- і f-подоболочек. Кожен енергетичний рівень, на який вони розщеплюються в магнітному полі, відповідає одній орбіталі в подоболочкі. Магнітне поле не впливає на s -подоболочки, так як вона складається всього з однієї s-орбіталі сферичної форми.
За відсутності магнітного поля все орбіталі однієї подоболочки мають однакову енергію. Орбіталі, що мають однакову енергію, називаються виродженими.
Атомні спектри елементів при певних умовах виявляють розщеплення, обумовлене наявністю у електрона особливої властивості -спіна, яке можна уявити собі як обертання електрона навколо власної осі. У напрямку це обертання може бути правостороннім (за годинниковою стрілкою) або лівостороннім (проти годинникової стрілки). Схематично це показано на рис. 1.20.
Таким чином, енергетичний рівень електрона в атомі визначається наступними чотирма характеристиками: оболонкою, подоболочкі, орбітал'ю і спіном. Кожній з цих характеристик зіставляється певне квантове число.
Чотири квантових числа. Головне квантове число (і). Це квантове число характеризує оболонку, в якій знаходиться електрон. Воно може приймати значення
Чим більше значення і, тим вище енергетичний рівень оболонки. Допоміжне (орбітальне) квантове число (l). Це квантове число характеризує подоболочкі, на якій знаходиться електрон. Воно може приймати значення
де n-головне квантове число. У подоболочкі з орбітальним квантовим числом / міститься 21 + 1 орбіталей. наприклад,
На рис. 1.21 показано відносне розташування енергетичних рівнів всіх s-, р- і d-подоболочек, що належать перших чотирьох електронним оболонок. Важливо звернути увагу на особливість 48-подоболочки: її енергетичний рівень розташовується нижче рівня 3<1-под обол очки.
Магнітне квантове число (т). Як було зазначено вище, все орбіталі однієї подоболочки в звичайних умовах мають вироджені (однакові) значення енергії. Однак під впливом зовнішнього магнітного поля орбітальні енергії стають дискретними, або квантовими.
Спіновий квантове число (s). Спіновий квантове число електрона може приймати тільки одне з двох значень: + 1I1 або -1I2.
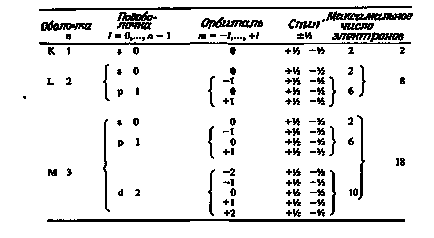
Можливі значення чотирьох квантових чисел для всіх електронів, які можуть розташовуватися на перших трьох оболонках, наведені в табл. 1.5. Слід зазначити, що кожен електрон має свій індивідуальний набір квантових чисел, яким він відрізняється від усіх інших електронів даного атома.
Таблиця 1.5. квантові числа
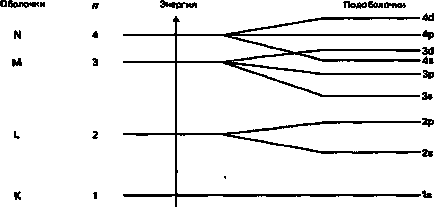
Мал. 1.21. Діаграма електронних енергетичних рівнів атома.