Квантові числа - хімія
Квантові числа - це енергетичні параметри, що визначають стан електрона і тип атомної орбіталі, на якій він знаходиться. Квантові числа необхідні для опису стану кожного електрона в атомі. Всього 4-ри квантових числа. Це: головне квантове число - n, орбітальне квантове число - l, магнітне квантове число - ml і спіновий квантове число - ms.
Головне квантове число - n.
Головне квантове число - n - визначає енергетичний рівень електрона, віддаленість енергетичного рівня від ядра і розмір електронного хмари. Головне квантове число приймає будь-які цілочисельні значення, починаючи з n = 1 (n = 1,2,3, ...) і відповідає номеру періоду.
Орбітальний квантове число - l.
Орбітальний квантове число - l - визначає геометричну форму атомної орбіталі. Орбітальний квантове число приймає будь-які цілочисельні значення, починаючи з l = 0 (l = 0,1,2,3, ... n-1). Незалежно від номера енергетичного рівня, кожному значенню орбітального квантового числа відповідає орбіталь особливої форми. "Набір" таких орбіталей з однаковими значеннями головного квантового числа називається енергетичним рівнем. Кожному значенню орбітального квантового числа відповідає орбіталь особливої форми. Значенням орбітального квантового числа l = 0 відповідає s-орбіталь (1-ин тип). Значенням орбітального квантового числа l = 1 відповідають p-орбіталі (3-ри типу). Значенням орбітального квантового числа l = 2 відповідають d-орбіталі (5-ть типів). Значенням орбітального квантового числа l = 3 відповідають f-орбіталі (7-м типів).
Значення орбітального квантового числа - l.
f-орбіталі мають ще більш складну форму. Кожен тип орбіталі - це обсяг простору, в якому ймовірність знаходження електрона - максимальна.
Магнітне квантове число - ml.
Магнітне квантове число - ml - визначає орієнтацію орбіталі в просторі щодо зовнішнього магнітного або електричного поля. Магнітне квантове число приймає будь-які цілочисельні значення від -l до + l, включаючи 0. Це означає, що для кожної форми орбіталі існує 2l + 1 енергетично рівноцінних орієнтацій в просторі - орбіталей.
l = 0, m = 0 - одна рівноцінна орієнтація в просторі (одна орбіталь).
l = 1, m = -1,0, +1 - три рівноцінні орієнтації в просторі (три орбіталі).
l = 2, m = -2, -1,0,1,2 - п'ять рівноцінних орієнтацій в просторі (п'ять орбіталей).
l = 3, m = -3, -2, -1,0,1,2,3 - сім рівноцінних орієнтацій в просторі (сім орбіталей).
Спіновий квантове число - ms.
Спіновий квантове число - ms - визначає магнітний момент, що виникає при обертанні електрона навколо своєї осі. Спіновий квантове число може приймати лише два можливих значення 1/2 і -1/2. Вони відповідають двом можливим і протилежним один одному напрямками власного магнітного моменту електрона - спинах. Для позначення електронів з різними спинами використовуються символи: 5 і 6.
Інформація про роботу «Квантові числа»
Розділ: Хімія
Кількість знаків з пробілами: 3028
Кількість таблиць: 2
Кількість зображень: 1
координати або імпульси, слід розглядати як т.зв. оператори. Перехід від чисел до операторів - одна з найбільш зухвалих ідей в сучасній науці. Не вдаючись в суть значень операторів, відзначимо, що на сьогоднішній день основна ідея квантової механіки зводиться до наступного: будь-яким фізичним величинам класичної механіки в квантовій механіці відповідають «свої» оператори, а чисельним.
Геттінгенського університету, з 1958 - директор Інституту фізики і астрофізики і професор Мюнхенського університету. Роботи в галузі квантової механіки, квантової електродинаміки, релятивістської квантової теорії поля, теорії ядра, магнетизму, фізики космічних променів, теорії елементарних частинок, філософії природознавства. У 1925 розробив матричну механіку - перший варіант квантової механіки (.
на фотоелементі. 5. Хімічна дія світла. Рішення задач (4 год) Письмовий залік (1 ч) Контрольна робота №3 (2 ч) Резерв (1 ч) Лабораторний практикум (10 год) 2. ОСОБЛИВОСТІ МЕТОДИКИ ВИВЧЕННЯ квантової ОПТИКИ Особливості методики вивчення даного розділу визначаються місцем цього розділу в шкільному курсі фізики і специфікою досліджуваного в ньому матеріалу. Розглянемо вплив кожного з.
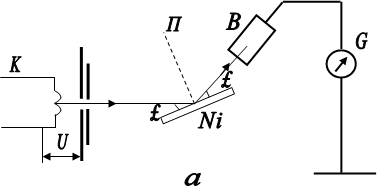
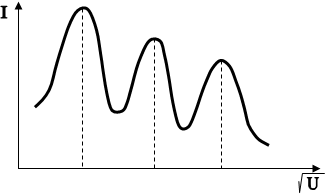

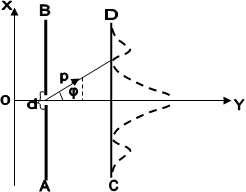
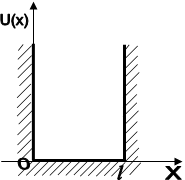
для систем, частінок з антисиметричних Хвильового функціямі, тобто до ферміонів. 2.2.3. Розподіл електронів за станами. Періодічна система елементів. Сукупність електронів, Які перебувають у всех можливий станах з однакової значення головного квантового числа n, утворює Електрон оболонки (електронний шар). Енергетичні шари Прийнято позначаті великими Латинська літерами відповідно до.