кругові процеси
Круговим процесом, або циклом. називається такий процес, коли система, пройшовши через ряд проміжних станів, повертається в початковий стан. Графічно кругової процес зображений на рис. 6.8 замкнутої кривої і складається з ділянки розширення (1А2) і стиснення (2b1).
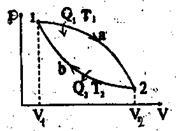
Для розширення газу від тіла з температурою Т1. званого нагрівачем. повідомляється кількість теплоти Q1. У процесі стиснення газ віддає кількість теплоти Q2 тілу з температурою Т2 <Т1. называемому холодильником .
Якщо цикл йде за годинниковою стрілкою, то він називається прямим. Позитивна робота розширення А, що здійснюється газом і чисельно рівна площі фігури (V1 1a2V2), більше негативної роботи стиснення А2. яку здійснюють над газом і виражається площею фігури (V2 2b1V1). Отже, робота А, досконала за цикл і чисельно рівна площі фігури (1а2b1), буде позитивна:
Прямий цикл використовується в теплових машинах - періодично діючих пристроях, що перетворюють тепло, отримане від нагрівача, в роботу А.
Так як в результаті кругового процесу система повертається в початковий стан, то зміна внутрішньої енергії, як функції стану, # 916; U = 0.
Отже, згідно з першого закону термодинаміки (6.21) для кругового процесу
З огляду на, що Q = Q1 - Q2. маємо:
Визначимо термічний коефіцієнт корисної дії циклу, як відношення роботи А до отриманої системою теплоті:
Чи може ККД теплового двигуна дорівнювати 100%?
Цикл (рис.6.8) може йти і проти годинникової стрілки. Тоді його робота буде негативна. Такий цикл називається зворотним і використовується вхолодільних машинах для перенесення (за рахунок роботи зовнішніх сил) теплоти від тіла з вищою температурою до тіла з температурою нижчою. Процес переходу системи зі стану 1 в стан 2 називається оборотним. якщо після повернення системи в початковий стан ні в системі, ні в навколишньому середовищі ніяких змін не відбувається. Будь-який процес, що не задовольняє цим умовам, називається необоротним.
Всі реальні процеси необоротні. Прикладом незворотності є процес теплообміну, при якому теплота мимоволі переходить від гарячого тіла до холодного, однак зворотного самовільного процесу статися не може.
Таким чином, оборотні процеси - поняття ідеалізоване. Однак їх вивчення важливо, оскільки багато реальні процеси в природі і техніці близькі до оборотних, і саме вони є найбільш економічними.
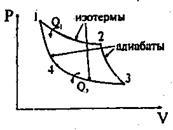
Грунтуючись на другому законі термодинаміки, С. Карно довів, що з усіх теплових машин найбільшим ККД мають оборотні машини. Найекономічнішим є круговий процес, що складається з двох ізотерм і двох адіабати (рис.6.9), названий циклом Карно.
Можна показати, що ККД циклу Карно визначається тільки температурами нагрівача Т1 і холодильника Т2:
Як випливає з (6.47), для підвищення # 951; необхідно збільшувати різницю температур Т1 нагрівача і Т2 холодильника.
З формул (6.46) і (6.47) випливає, що і
Врахуємо, що кількість тепла Q2. відданого холодильника негативно. Тоді остання рівність можна записати:
Ставлення Q / T називається наведеної теплотою.
Наведена теплота, передана системі нагрівачем, при нескінченно малому її зміні, дорівнює # 948; Q / Т. Можна показати, що для будь-якого оборотного кругового процесу сума наведених теплот дорівнює нулю. Тоді вираз (6.48) в загальному, вигляді може бути записано як:
Рівність нулю інтеграла по замкненому контуру означає, що в оборотному процесі підінтегральний вираз є повний диференціал деякої функції S, залежить тільки від стану системи. Функція S називається ентропією.
З формули (6.49) випливає, що для оборотних процесів зміна ентропії
Можна показати, що для необоротних нерівноважних процесів, що відбуваються в замкнутій системі, ентропія зростає
Співвідношення (6.51) і (6.52) об'єднуються в нерівність Клаузиса:
тобто ентропія замкнутої системи або зростає, або залишається постійною.
Так як реальні процеси необоротні, то можна стверджувати, що всі процеси, що протікають в замкнутій системі, ведуть до збільшення ентропії. Це твердження, зване принципом зростання ентропії. є ще одним формулюванням другого закону термодинаміки.
Фізичний сенс ентропії з'ясував Л.Больцман, який показав, що ентропія пов'язана з термодинамічної ймовірністю стану системи. Термодинамічна ймовірність w визначається як число способів, якими може бути реалізовано дане стан системи. Згідно Больцману, зв'язок S і w виражається формулою:
де k - постійна Больцмана.
Коли досягається рівноважний стан системи, то в цьому стані система може залишатися як завгодно довго, тобто параметри системи не змінюються і в системі відсутні потоки енергії або речовини. Якщо потоки мають місце, то зміна внутрішньої енергії dU може відбуватися не тільки за рахунок повідомлення системі теплоти # 948; Q і здійснення над нею роботи # 948; А, але і за рахунок перенесення маси. Тоді перший закон термодинаміки можна записати в більш загальній формі
dU = # 948; Q - PdV + # 956; dn,
де називається хімічним потенціалом і представляє зміна енергії системи, що припадає на одну частинку, яка бере участь в перенесенні при V = const і S = const.
Фазою називається термодинамічно рівноважний стан речовини, відрізняються не хімічним складом, а фізичним властивостями від інших рівноважних станів того ж речовини (наприклад, вода може перебувати в трьох фазах: рідкому, твердому і у вигляді пари). Перехід речовини з однієї фази в іншу називається фазовим переходом.
Розрізняють фазові переходи I і II роду. Фазовий перехід I роду пов'язаний з поглинанням або виділенням тепла (наприклад, плавлення і кристалізація). Фазовий перехід II роду не пов'язані з теплотою (наприклад, перехід деяких речовин при певних температурах в надпровідний стан см. П.5.7).
Для характеристики фазових переходів використовуються діаграми станів (зазвичай в координатах Р - Т). На цих діаграмах можна знайти точку одночасного рівноважного здійснення трьох фаз - потрійну точку. Наприклад, потрійна точка для води 273,16 К. Термодинаміка дозволяє розрахувати рівновагу двох фаз одного речовини, користуючись рівнянням Клапейрона - Клаузіуса:
,
де похідна від рівноважного тиску по температурі залежить від теплоти фазового переходу # 955 ;, температури переходу і зміни обсягу фаз (наприклад, при замерзанні води її об'єм збільшується).