гомогенна система
Гомогенною (від гомо. І. Ген), термодинамічна система, все характеристики якої (наприклад, хімічний склад, щільність, тиск) постійні або змінюються в просторі безперервно. Гомогенними можуть бути газові суміші, рідкі або тверді розчини та інші системи. Розрізняють просторово однорідні і неоднорідні гомогенні системи. У однорідних гомогенних систем властивості в різних частинах системи однакові, у неоднорідних - різні. Приклади просторово неоднорідних гомогенних систем: гази, рідини, газові суміші, розчини в зовнішньому полі за умови, що при відсутності поля вони просторово однорідні. Однак завдяки безперервному зміни властивостей в неоднорідній гомогенної системі, на відміну від гетерогенної системи, немає частин, обмежених поверхнями розділу, на яких хоча б одна властивість змінювалося стрибком. Гомогенна система однофазні, але може бути багатокомпонентною.
ГОМОГЕННИЙ КАТАЛОЗІ, збільшення швидкості хімічних реакцій, що протікають в газовій або рідкій фазі, в результаті дії каталізаторів, які перебувають в одній фазі з реагентами. Гетерофазна реакція СО + Н2 Про → ← СО2 + Н2 також може бути гомогенною каталітичної реакцією, оскільки проходить в об'ємі розчину каталізатора (наприклад, Rhl3) з розчиненим СО.
Характеристики гомогенно-каталітичних процесів. Основними характеристиками гомогенного каталітичного процесу є величини активності каталізатора і селективності каталізуються реакції. Селективність може бути представлена через частку прореагировавшего вихідного реагенту, перетвореного в цільової продукт з урахуванням стехиометрии реакції. Для вираження каталітичної активності використовують відношення початкової або стаціонарної швидкості реакції до молярної концентрації активної форми каталізатора - так звану швидкість (або частоту) оборотів каталізатора (позначається TOF, від англійського turn-over frequency). На практиці часто застосовують пов'язану з TOF, але не ідентичну їй величину - відношення сумарного мольної кількості продукту реакції до сумарного мольному кількості каталізатора і до часу реакції, яку також називають TOF. Наочною характеристикою активності і стабільності роботи каталізатора є число обертів каталізатора (TON, turn-over number), яка дорівнює кількості каталітичних циклів в перерахунку на 1 моль каталізатора (виражається ставленням мольної кількості продуктів реакції до мольному кількості каталізатора).
Класифікація гомогенно-каталітичних процесів і їх механізми. Виходячи з природи каталізатора, т. Е. Специфічних можливостей для взаємодії з субстратом, гомогенні каталітичні процеси поділяють на такі види: кислотно-основний каталіз протонними кислотами або підставами Бренстеда, електрофільні (за участю апротонних кислот Льюїса) і нуклеофільний (за участю підстав Льюїса) каталіз, металокомплексні каталіз комплексними сполуками металів, каталіз органічними синтетичними сполуками, а також ферментативний каталіз.
Кислотний каталіз - активація субстратів, що мають вільні електронні пари, протонними кислотами (дивись Кислоти і підстави) - відбувається в результаті приєднання протона кислоти НА до субстрату. Протонирование субстрату в водних розчинах кислот є зазвичай реакцією заміщення води в гідратованому катіоні Н (Н2 О) + n молекулою субстрату. Проміжними активними частинками в кислотному каталізі часто служать іони карбенів R +. які так само, як і протон, сольватовані молекулами Н2 О, органічних розчинників або сильних кислот, наприклад R (H2 O) +. (С2 Н5) 3 O +. RH2 SO + 4. Основний каталіз - активація підставами Бренстеда - відбувається в результаті відщеплення протона підставою від субстрату з утворенням з молекули субстрату анионной частки, що є дуже сильним нуклеофілом. Таким чином, гідратацію алкенов в присутності сильних мінеральних кислот - типову кислотно-каталітичну реакцію - можна представити у вигляді послідовності стадій:
альдольної конденсацію ацетону в присутності лугів - приклад основного каталізу - у вигляді:
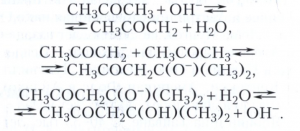
Дуже сильні протонні кислоти (сверхкіслоти) здатні протегувати з'єднання, що не мають вільних електронних пар, наприклад алкани, з утворенням іонів Карбонія RH + 2 (CH + 5 і ін.). Іони Карбонія беруть участь в реакціях алкілування, крекінгу і ізомеризації алканів.
Електрофільні каталіз - активація електрофільними апротонного кислотами Льюїса - супроводжується зниженням електронної щільності на реакційному центрі субстрату (підстави Льюїса) аж до утворення іона карбенів. За таким механізмом відбувається, зокрема, алкілування ароматичних з'єднань; наприклад, алкілування бензолу алкілбромідом за схемою C6 H6 + RBr → C6 H5 R + НВr включає освіту реакційноздатного комплексу R + [Al2 Br7] - в результаті взаємодії каталізатора Аl2 Br6 з алкілбромідом і дію катіона карбенів R + на молекулу бензолу.
У реакціях галогенсодержащих молекул (CBr4. RCOCl, SO2 Cl2 та ін.) З Аl2 Вr6 або Аl2 Сl6 виникають суперелектрофільние частки (наприклад, СВR + 3 Аl2 Вr - 7). Суперелектрофіли каталізують крекінг алканів в м'яких умовах.
Протонні і апротонних (електрофільні) каталізатори прискорюють процеси алкилирования, ацилирования, дієновий синтез і навіть деякі окислювально-відновні реакції. Наприклад, протонні кислоти каталізують окислення изопропанола тріфенілкарбінолом до ацетону через стадію утворення тріфенілметільного катіона (С6 Н5) 3 С +. апротонні кислоти (алкоголяти алюмінію) - відновлення кетонів спиртами (Меєрвейна - Понндорфа - Верлея реакція) і диспропорционирование альдегідів (Тищенко реакція) через стадію утворення комплексу між алкоголятов Al і карбонільним з'єднанням.
Нуклеофільний каталіз підставами Льюїса відбувається з утворенням проміжного продукту приєднання каталізатора-нуклеофіла до субстрату (наприклад, при електрофільне бромуванні алкенов в присутності галогенид-іонів) або з утворенням проміжного продукту заміщення (прикладом заміщення у насиченого атома С є гідроліз алкилгалогенидов в присутності аниона I - - активного нуклеофильного каталізатора і потім легко замещаемой групи).
При каталізі органічними сполуками функції каталізаторів, як правило, більш складні, ніж електрофілов або нуклеофілів. Приклади цього виду гомогенного каталізу - автокаталіз гліколевим альдегідів конденсації формальдегіду до цукрів в основних середовищах (реакція Бутлерова), розкладання пероксидних радикалів, що каталізує n-бензохинона за схемою
каталіз амінокислотою (пролином) альдольної конденсації, манних реакції та інших процесів.
У більшості процесів каталіз комплексами металів реалізується через проміжні металокомплексні інтермедіати, в тому числі і в типових окисно-відновних процесах за участю неорганічних реагентів. Наприклад, при каталізі комплексами Мо (III) відновлення молекулярного азоту амальгамою натрію за схемою N2 + 4Na + 4Н2 O → NH2 NH2 + 4NaOH утворюється в результаті взаємодії N2 з Мо (III) комплекс [Мо 4+ -N = N-Мо 4+ ] при дії Na перетворюється на аніон [Mo 4+ = N-N = Mo 4+] 2; реакція цієї проміжної частинки з Н2 О і призводить до утворення гідразину (реакція відкрита А. Е. Шиловим з співробітниками). Лише для невеликого числа реакцій перенесення електронів, що каталізують комплексами металів, характерний відбувається без утворення інтермедіатів зовнішньосферних перенесення електрона.
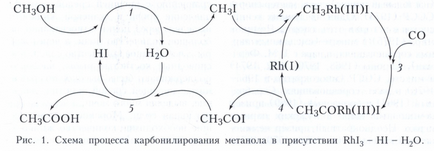
Найбільш поширений тип металлокомплексного гомогенного каталізу - каталіз реакцій органічних сполук з утворенням металоорганічних інтермедіатів зі зв'язками метал-вуглець, так званий металоорганічного каталіз. Характерні стадії металоорганічного каталізу можна проілюструвати на прикладі двох процесів. Перший - промислове отримання оцтової кислоти карбонілюванням метанолу в каталітичної системі RhI3 - HI - Н2 O. Сіль Rh (III) є прекурсором активного каталізатора - комплексу Rh (I), що утворюється по реакції RhI3 + 3СО + Н2 O - Rh (CO) 2 I - 2 + СO2 + HI + Н +. Механізм процесу можна зобразити циклічної послідовністю стадій (рис. 1). Стадія 1 - заміщення на галоген гідроксильної групи, стадія 2 - окисне приєднання СН3 I до Rh (I), стадія 3 - впровадження СО по зв'язку СН3 -Rh, стадія 4 - відновне елімінування аціліодіда CH3 COI, стадія 5 - нуклеофільне заміщення I - в аціліодіде водою. У цьому процесі, крім комплексу Rh (I), бере участь протонний кислотний каталізатор HI в двох каталітичних циклах. Такі системи називають поліфункціональними каталитическими системами.
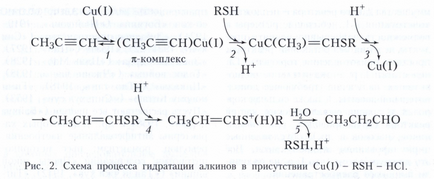
Другий приклад - гідратація алкінів за участю трьох каталізаторів: комплексів Cu (I) (металокомплексні каталіз), тіолу RSH (нуклеофільний каталіз) і HCI (протонний кислотний каталіз), що протікає проти правила Марковникова (рис. 2). Стадія 1 - освіту π-комплексу, стадія 2 - нуклеофільне приєднання RSH до π-комплексу, стадія 3 - електрофільне заміщення Cu (I) протоном, стадія 4 - електрофільне приєднання Н + (протонирование тіопропенілового ефіру), стадія 5 - нуклеофільне заміщення тіолу водою .
У металокомплексні каталізі виділяють асиметричний каталіз з використанням хіральних металокомплексних каталізаторів, що дозволяють проводити реакції стереоселективно (дивись в статті Асиметричний синтез). Наприклад, в промисловості на комплексах Rh (I) з хіральними фосфінових лигандами отримують дигідроксифенілаланін (препарат для лікування хвороби Паркінсона).
Важлива технологічна проблема металлокомплексного каталізу - відділення каталізаторів від продуктів і рециклізація каталізаторів - вирішується за рахунок іммобілізації комплексів металів за допомогою лігандів на поверхні носіїв або в одній з фаз при використанні двофазних систем (наприклад, органічна фаза і вода, в якій розчинений комплекс металу), використання розплавів органічних солей (іонних рідин), в яких иммобилизован комплекс металу, застосування мембран для відділення продуктів ультрафильтрацией, а також викорис тання термоморфних лігандів або розчинників, що змінюють в залежності від температури фазовий стан.
Практичне застосування. До числа найважливіших промислових гомогенно-каталітичних процесів (крім названих вище) відносяться синтези за участю СО, олігомеризація етилену з крос-метатезіс термінальних і інтернальних алкенов, димеризація етилену і пропилену, гідрування функціонально заміщених алкенів, нітросполук, епоксидування пропілену, окислення алкилароматических з'єднань і ін . Багато металокомплексні каталітичні процеси за активністю каталізаторів, хемо, регио- і стереоселективності наближаються до ферментативним. Використання структурних і функціональних моделей ферментів, принципів протікання біохімічних процесів дозволяє створювати ефективні процеси металлокомплексного каталізу (дивись біоміметичні реакції).