гіпопластичні анемії
До гіпо- та апластична анемія відносять анемії з безперервно прогресуючим перебігом, що розвиваються в результаті глибокого пригнічення кровотворення.
Етіологія їх досить різноманітна і до кінця ще не з'ясована. За етіологічним ознакою розрізняють генуінние гипопластические анемії, які спостерігаються в переважній більшості випадків, і форми відомої етіології, пов'язані з певними шкідливими впливами. У розвитку перших провідну роль, мабуть, грає своєрідно змінена (перекручена) індивідуальна реактивність організму. Не виключається також конституційно-спадковий генез їх, пов'язаний з вродженою ендокринної недостатністю.
У розвитку гипопластических анемій відомої етіології важливу роль відіграють різні зовнішні чинники. До них відносяться:
1. Лікарські засоби - сульфаніламіди, вісмут, препарати золота, стрептоміцин. левоміцетин, цитостатики, зокрема похідні хлоретіламіна і протипухлинні антибіотики.
2. Хімічні препарати - різні барвники, пари ртуті, бензин, бензол і його похідні і ін.
3. Промениста енергія (промені Рентгена, радій, радіоізотопи).
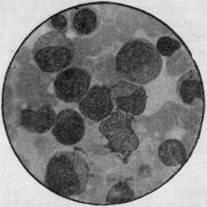
Мал. 10. Пунктат кісткового мозку при гіпопластичний анемії.
Порушення дозрівання мієлоїдних елементів на стадії миелоцитов і базофільних еритробластів (іммерсія).
V. Апластичнаанемія, діагноз якої правомірний лише у випадках, що наближаються за станом кісткового мозку до панміелофтіз. Ось чому без дослідження кісткового мозку термін «апластична анемія» втрачає будь-який сенс, гак як клінічно провести чіткі межі між гипопластической і апластичної анемії не представляється можливим.
Повсякденний клінічний досвід свідчить про те, що зазначені варіанти не є стабільними, так як в основі їх лежить глибоке порушення процесів кровотворення, що характеризується прогресуючим зниженням темпів проліферації аж до повного спустошення діяльного кісткового мозку з заміною його жировою тканиною. Це, в свою чергу, служить лише доказом динамічності і варіабельності патологічного процесу.
У диференціальної діагностики гипопластических анемій слід мати на увазі алейкемічна лейкоз, хвороба Верльгофа і гемолітична анемія з переважно внутрішньосудинним гемолізом (хвороба Маркіафави - Мікеле).
У таких випадках правильний діагноз може бути встановлений тільки на підставі даних стернальной пункції і трепано- біопсії.
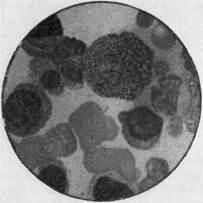
Мал. 11. Виражена ерітробластіческого реакція кісткового мозку при парциальной гіпопластична анемія (іммерсія).
Гіпопластичні анемії зазвичай характеризуються підгострим або хронічним перебігом з періодичними загостреннями, змінюються періодами ремісій або деякого поліпшення під впливом комплексної терапії. Однак у фазі ремісії, незважаючи на тривалу клініко-гематологічну компенсацію, часто зберігаються виражені порушення гемопоезу (лейко-гранулоцитопенія, тромбоцитопенія, а при дослідженні кістково пунктата - зниження вмісту 1 миелокариоцитов, гранулоцитопенія і пригнічення мегакаріоцітопоеза). Все це свідчить про повільному темпі репаративних процесів і збереження неповноцінності (дефектності) кровотворення (Ф. Е. Файнштейн з співавт. 1975). Тривалість життя при гипопластических анеміях коливається від 2 до 7 і навіть 15 років. На відміну від них апластичні анемії протікають гостро або підгостро (від 1 до 6 міс) і дають високий відсоток смертності. Причиною останньої є зазвичай пневмонії, що носять фібринозний або фібринозно-геморагічний характер з вогнищами некрозу, занепад серцевої діяльності в зв'язку з різкою анемізації, крововиливи в мозок.
Лікування. У комплексній терапії гипопластических анемій домінуючу роль відіграють переливання крові (200 - 250 мл) або еритроцитної маси (100-125 мл) з інтервалами в 1-4 дня. Більш доцільно застосування свежестабілізірованной або катіонітного крові (заготовлюється за допомогою іонообмінних адсорбентів), властивості якої дуже близькі до крові донорів. У тих випадках, коли різко знижується кількість лейкоцитів або тромбоцитів, показані трансфузии лейкоцитной (не менше 10-12 млрд. Лейкоцитів) або тромбоцйтной маси (не менше 150-200 млрд. Тромбоцитів). К. жаль, при багаторазових переливань крові не виключається можливість утворення в організмі реципієнта протіволейкоцітарних і протівотромбоцітарних антитіл. У таких випадках звичайні імунодепресанти неспроможні через токсичного їх дії на кістковий мозок, а переливання відмитих еритроцитів малоефективні, оскільки захворювання часто супроводжується геморагічним синдромом. З цією метою допустимо лише застосування АКК, що володіє інгібуючим впливом на ізоантітела у хворих гіпо- та апластичну анемію. Препарат застосовують всередину по 5-10 г або внутрішньовенно 5% розчин по 100-200 мл (до 20 вливань, керуючись динамікою титру циркулюючих антитіл).
Гемотерапію слід поєднувати з комплексним застосуванням вітамінів групи В як регуляторів і стимуляторів еритропоезу. Останні застосовують протягом 6-7 тижнів в наступних дозах: B1 - по 2 мл 5% розчину підшкірно щодня; В2 - За 5 мг 3 рази на день всередину; В6- по 50 мг щодня внутрішньом'язово; В12 - по 100 мкг внутрішньом'язово через день; нікотинову і фолієву кислоти - по 30 мг 3 рази на день всередину.
Застосування вітамінів групи В, гемотрансфузій, а також сосудоуплотняющіх і кровоспинних засобів забезпечує ефект приблизно в 30% випадків (за нашими спостереженнями, переважно у осіб з хронічним варіантом і початковою стадією підгострій гіпопластична анемія з помірним порушенням гемопоезу). У решти хворих цей метод лікування служить лише підготовкою до наступних пересадки кісткового мозку і спленектомії.
У комплексній терапії гипопластических анемій широко використовують кортикостероїдні гормони, які мають багатостороннім механізмом лікувальної дії: замінних (враховуючи можливе зниження глюкокортикоїдної функції надниркових залоз у хворих гипопластической анемією), гемостимулюючі, сосудоуплотняющім і гиперкоагуляционного ефектами, пригнічують гемоліз і патологічний иммуногенез. Призначення їх особливо виправдано при наявності вираженої кровоточивості, гемолитического синдрому, імунологічних зрушень, а також в разі проведення міелотрансплантацій. Для досягнення терапевтичного ефекту добова доза преднізолону повинна бути з розрахунку 0,5 мг на 1 кг маси хворого (протягом 2-3 тижнів) з подальшим переходом на підтримуючі дози (15-20 мг). Збільшення її допустимо тільки при наростанні панцитопении, посилення кровоточивості і під час гемолітичних кризів.
Тривалість лікування кортикостероїдними гормонами строго індивідуальна (від .4 тижнів до 3-4 міс) в залежності від клінічного перебігу.
Лікування кортикостероїдами необхідно поєднувати із застосуванням анаболічних гормонів (метандростенолон, метиландростендіол, ретаболіл) і калію хлориду (по 0,5 г 2-3 рази на день).
Серед різних методів лікування гіпо- та апластичні анемій одне з провідних місць займає пересадка гомологичного кісткового мозку; показанням служить відсутність у хворих клінічного ефекту від попереднього лікування глюкокортикоїдами і гемостимулюючі засобами. Кістковий мозок вводять в разовій дозі по 100-150-200 мл (з наявністю ядерні клітинних елементів від 2 до 6 млрд.). Підбір донора і реципієнта при цьому проводиться з урахуванням групи крові, резус-фактора і лейкоцитарних антигенів. Зазвичай проводять повторні пересадки кісткового мозку (від 2 до 5 разів) з дотриманням певних інтервалів між ними (пізніше 1-го тижня або через місяць після попередньої пересадки). Це диктується термінами можливої появи антитіл у відповідь на введення донорського кісткового мозку (через 1-2 тижні) і тривалістю циркуляції їх в крові (протягом 4-5 тижнів).
Механізм терапевтичної дії міелотрансплантацій повністю ще не вивчений. У зв'язку з цим існує дві гіпотези - гуморальної стимуляції і клітинної трасплантації. Мабуть, мають значення обидва чинники, хоча переважна роль кожного з них визначається конкретними умовами: при гіпоплазії кровотворення провідне значення належить гуморальної стимуляції, при аплазії кісткового мозку - клітинної трансплантації. За спостереженнями Ф. Е. Файнштейна (1965), з 44 хворих, яким були проведені пересадки кісткового мозку, у 26 наступила ремісія, а у решти сприятливий ефект був відсутній. За даними Київського ін- * ститутов гематології та переливання крові (А. Ф. Романова, 1973), значне клінічне поліпшення спостерігалося у 53 з 121 хворого гипопластической анемією (при аплазії кісткового мозку пересадки кісткового мозку неефективні). Тривалість ремісії становить приблизно від 1 року до 4-6 років, в середньому близько 2 років.
Негативною стороною міелотрансплантацій є розвиток так званої «вторинної хвороби», як наслідок імунологічної активності «трансплантата проти хазяїна», тобто імунологічного конфлікту, при якому прижилося трансплантат, багатий імунокомпетентними клітинами (в даному випадку кістковий мозок) поводиться агресивно по відношенню до клітинних і тканинних структур нового господаря. Однак пересаджений кістковий мозок - джерело чужорідних антигенів, що сприяють утворенню імунних антитіл не тільки проти клітинних елементів донора, а й проти власних клітин реципієнта. В результаті цього не виключається загибель трансплантата або прогресування анемії за рахунок вторинних імунологічних порушень.
Однією з ознак розвитку «вторинної хвороби» вважається виявлення в крові хворого імунних антитіл за допомогою реакції Кумбса. При цьому позитивна пряма проба Кумбса свідчить про наявність антитіл, що виробляються трансплантованою тканиною. Позитивна непряма проба вказує на присутність неповних антитіл по відношенню до еритроцитів донора, тобто є показником імунологічної активності реципієнта.
Для попередження імунологічного конфлікту між донором і реципієнтом (зокрема, для придушення імунологічної активності останнього) пересадки кісткового мозку слід поєднувати з кортикостероїдної терапією або з спленектомія. Видалення селезінки саме по собі сприятливо впливає на перебіг гіпопластична анемія, забезпечуючи іноді ремісію на багато років. Так, за зведеною статистикою Ф. Е. Файнштейна (1965), з 86 хворих гипопластической і апластичну анемію, підданих спленектомії, клінічна ремісія або покращення спостерігалися у 43, відсутність ефекту - у 27 і смертельний результат в післяопераційному періоді - у 16 хворих.
Спленектомія усуває гальмівний вплив селезінки на кістково-мозкове кровотворення, сприяючи значному поліпшенню внутрішньоклітинного обміну і синтезу ДНК і тим самим підвищенню проліферативної активності кісткового мозку. Поряд з цим відзначається поліпшення функціонального стану судин і підвищення общекоагулірующей активності крові (Ф. Е. Файнштейн, Д. М. Гроздов з співавт. 1969).
З видаленням селезінки зникає плацдарм імуногенезу, що особливо важливо при лікуванні хворих гипопластической анемією з гемолітичним компонентом. Особливо ефективно поєднання спленектомії з пересадками кісткового мозку, так як при цьому створюються оптимальні умови для приживлення трансплантата, що частіше сприяє досягненню сприятливих зрушень в гемопоезі і більш ранніх ремісій. За нашими спостереженнями (Г. А. ДАШТАЯНЦ, С. С. Лаврик, А. Ф. Романова,
1975), сприятливі результати після спленектомії зберігалися протягом 3-10 років (в середньому 4,5 року).
Ми вважаємо, що спленектомія показана хворим гипопластической анемією в тих випадках, коли попередня активна терапія, що включає трансплантації кісткового мозку, виявляється безрезультатною, а також хворим з наявністю імунних антитіл та гемолітичних проявів. Хворим парціальної гипопластической анемією, характеризується збереженим тромбоцітопоеза, показання до спленектомії повинні ставитися обережно в зв'язку з можливим розвитком в післяопераційному періоді гіпертромбоцитоз і мігруючих тромбозів. Спленектомія не відображено при апластичної анемії, де прогноз абсолютно безнадійний.
Завдяки комплексній терапії гипопластических анемій в даний час вдається досягти тривалих ремісій і знизити смертність. Якщо за період з 1944 по 1954 р летальність при вищевказаних захворюваннях становила 68%, то з 1954 по 1961 р вона знизилася до 36% (Ф. Е. Файнштейн, 1965), що можна, без сумніву, зв'язати з введенням в останні роки в комплексну терапію захворювання трансплантацій кісткового мозку і спленектомії. В даний час переглянуто питання
про пересадку аллогенного кісткового мозку (використання гістосумісності кісткового мозку, застосування імунних депрессантов). Раціональне застосування різних лікувальних заходів сприяє досягненню терапевтичного ефекту навіть у хворих з важким перебігом процесу.
Профілактика гіпо- та апластичні анемій зводиться до дотримання суворих заходів захисту на виробництвах і в професіях, пов'язаних з впливом на організм шкідливих факторів (рентгенових промені, бензол і ін.). Робочі промислових підприємств, де є певні професійні шкідливості, що впливають на гемопоез (барвники, пари ртуті, бензин, бензол і т. П.), Мають потребу в систематичному гематологічному контролі не менше 2 разів на рік. Необхідно обмежити безконтрольне вживання медикаментів, що володіють цітопеніческім дією. Особам з парціальної цитопенії протипоказано призначення препаратів, що володіють пригнічують на гемопоез; в процесі медикаментозної і рентгенорадіотерапіі слід проводити систематичний контроль за складом крові (не рідше 1 разу на тиждень). Хворі гипопластической анемією підлягають постійному диспансерному спостереженню. Вони повинні уникати переохолодження, перегрівання і тривалої інсоляції, що загрожує рецидивами захворювання. Таким хворим протипоказані контакти з факторами мієлотоксичного дії, а також призначення лікарських засобів, що роблять депресивний вплив на кровотворення.