Деякі лугу - студопедія
Гідроксид натрію NaОН - тверде білу речовину, гігроскопічна і тому розпливається на повітрі; добре розчиняється у воді, при цьому виділяється теплота. Розчин гідроксиду натрію в воді Милка на дотик і дуже їдкий. Він роз'їдає шкіру, тканини, папір і інші матеріали. За це властивість гідроксид натрію отримав назву їдкого натру. З гідроксидом натрію і його розчинами треба поводитися обережно, побоюючись, щоб вони не потрапили на одяг, взуття, а тим більше на руки і обличчя. На шкірі від цієї речовини утворюються довго не загоюються рани. NaОН застосовують в миловарінні, шкіряної і фармацевтичної промисловості.
Гідроксид калію кон- теж тверде біле речовина, добре розчинна у воді, з виділенням великої кількості теплоти. Розчин гідроксиду калію, як і розчин їдкого натру, милок на дотик і дуже їдкий. Тому гідроксид калію інакше називають їдкий калій. Застосовують його в якості добавки при виробництві мила, тугоплавкого скла.
Гідроксид кальцію Са (ОН) 2 або гашене вапно, - пухкий білий порошок, трохи розчинний у воді (в таблиці розчинності проти формули Са (ОН) а стоїть буква М, що означає малорастворпмое речовина). Виходить при взаємодії негашеного вапна СаО з водою. Цей процес називають гасінням. Гідроксид кальцію застосовують у будівництві при кладці і штукатурці стін, для побілки дерев, для отримання хлорного вапна, яка є дезинфікуючим засобом. Прозорий розчин гідроксиду кальцію називається вапнякової водою. При пропущенні через вапняну воду СО2 вона мутніє. Такий досвід є для розпізнавання вуглекислого газу. Реакції, за допомогою яких вони розпізнають певні хімічні речовини, називають якісними реакціями.
Для лугів теж існують якісні реакції, за допомогою яких розчини лугів можна розпізнати серед розчинів інших речовин. Це реакції лугів з особливими речовинами - індикаторами (лат. «Покажчиками»). Якщо до розчину лугу додати кілька крапель розчину індикатора, то він змінить свій колір (табл. 4).
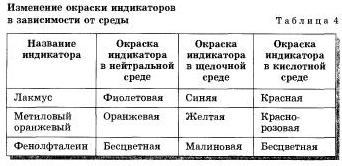
У таблиці 4 наведені індикатори і зазначено зміна їх забарвлення в лужному середовищі, а також в кислотному середовищі.
1. Підстави - це складні речовини, що складаються з іонів металів і гідроксид-іонів. Приклади формул підстав: KOH, Mg (OH) 2.
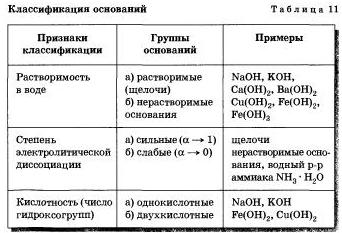
2. Підстави бувають однокіслотние і многокіслотние. Однокіслотние - підстави, в формулах яких вказано один гідроксид-іон: KOH, NaOH. Многокіслотние - підстави, в формулах яких два і більше гідроксид-іонів: Ca (OH) 2. 3. Всі підстави - тверді речовини. Тому їх поділяють не по агрегатному стані, а по розчинності у воді. За цією ознакою підстави поділяють на дві групи - розчинні і нерозчинні підстави. 4. Розчинні (їх називають лугами). Такі підстави утворюють метали головної підгрупи I групи - Li, Na, K, Rb, Cs, Fr (ці метали називають лужними), а також деякі метали головної підгрупи II групи - Ca, Sr, Ba (ці метали називають лужно-земельними). всі підстави, крім розчину аміаку у воді, є тверді речовини, що мають різне забарвлення. Наприклад, гідроксид кальцію Са (ОН) 2 білого кольору, гідроксид міді (II) Сu (ОН) 2 блакитного кольору, гідроксид нікелю (II) Ni (OH) 2 зеленого кольору, гідроксид заліза (III) Fе (ОН) 3 червоно бурого кольору і т. д.Водний розчин аміаку NH3 * H2O на відміну від інших підстав містить не катіони металу, а складний однозарядний катіон амонію NH4 і існує тільки в розчині (цей розчин вам відомий під назвою нашатирного спирту). Він легко розкладається на аміак і воду:
Поділ підстав на групи за різними ознаками представлено в таблиці 11.
Всі підстави, і в першу чергу лугу (сильні електроліти), утворюють при дисоціації гідроксид-іони ОН, які і обумовлюють ряд загальних властивостей: милкость на дотик, зміна забарвлення індикаторів (лакмус, метилового оранжевого і фенолфталеїну), взаємодія з іншими речовинами.