Анодні процеси - студопедія
У загальному вигляді анодний процес записується:
Залежно від агрегатного стану одержуваних продуктів анодні процеси прийнято розділяти на окислювально-відновні процеси без виділення самостійної фази, процеси з утворенням твердих анодних продуктів, процеси з газовиділенням, процеси з розчиненням матеріалу анода (розчинні аноди).
До процесів без виділення самостійної фази відносяться процеси отримання сильних окислювачів.
При хлоруванні концентрованих лужних розчинів протікають реакції з утворенням гіпохлоритів і хлорнуватисту кислоти:
Cl2 + ОН - = НС1О + Cl - (3.44)
Далі гіпохлорит окислюється на аноді до хлората:
Другий приклад - освіту надсірчані кислоти приелектрохімічному окисленні концентрованих розчинів сірчаної кислоти:
з подальшою димеризації радикалів
Аналогічним чином на аноді отримують іон перманганату:
Так само як у випадку протікання подібних процесів на катоді, поляризація анода носить концентраційний характер і визначається труднощами в доставці до анода відновленої форми речовини і відведення від поверхні анода окисленої форми речовини. Розподіл їх активностей в приелектродному шарі показано на рис.3.9, а поляризаційна крива для катодного і анодного процесів приведена на рис.3.10.
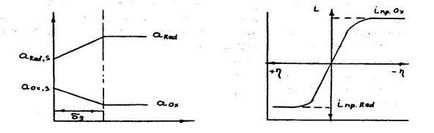
Ріс.3.9.Распределеніе активностей рис.3.10. Вид поляризационной в пріанодном шарі кривої
При цьому величина поляризації буде пов'язана з величиною щільності струму рівнянням:
Прикладом процесів з утворенням на аноді твердих продуктів є електролітичне отримання МnО2.
Процес зводиться до окислення на аноді іонів марганцю двовалентного і тривалентного до чотирьохвалентного стану:
Крім того, іони Мn 4+ виходять при диспропорционирование іонів Mn 2+:
2Mn 3+ = Мn 2+ + Мn 4+. (3.52)
Подальшу освіту МnО2 відбувається за рахунок реакцій гідролізу:
Помітну роль в цьому процесі відіграє фазова поляризація.
При високій щільності струму, низьких температурах і концентраціях Мn 2+ зростає фазова поляризація, в результаті виходить тонкозерниста двоокис марганцю. При низьких анодних щільності струму, високих концентраціях Мn 2+ і температурах фазова поляризація зменшується, що дозволяє отримувати крупнокристалічного двоокис марганцю.
Таким же шляхом отримують PbO2. SnО2 і інші продукти.
Широко поширені в гідрометалургії анодні процеси з газовиділенням, наприклад процеси отримання хлору електролізом водних розчинів NaCI, процеси отримання кисню при електролітичному розкладанні води. Поляризація при цьому, як правило, носить фазовий характер і визначається або труднощами, пов'язаними з рекомбінацією адсорбованих атомів в молекули, або з утворенням і розпадом на поверхні анода складних з'єднань. Це наочно видно на залежностях величини поляризації від матеріалу анода (рис.3.11 і 3.12). Виділення кисню відбувається по реакціях:
в розчинах солей і лугів:
в розчинах сильних кислот:
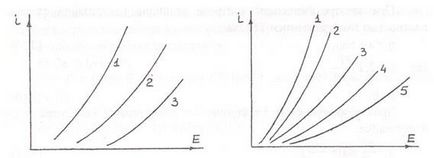
Ріс.3.11.Полярізація анода при Ріс.3.12Полярізація анода при
виділення хлору з розчинів NaCl виділення кисню з 0,1Н KOH
(250г / л) при 80 ° С.Матеріал анода: при 17 ° С. Матеріал анода:
1-Pt; 2-графіт; 3-магнетит 1-Cu; 2-Ni; 3-Ag; 4-графіт; 5-Pt
Найвищі значення перенапруги виділення кисню характерні для металів платинової групи, яким властиві малі значення перенапруги виділення водню. Залежність перенапруги від щільності струму носить тафелевскій характер:
h = а + blgi. (3.57)
Коефіцієнти а і b змінюються з щільністю струму, що пов'язано з різним характером утворюються проміжних фаз. Так, на платиновому аноді зі збільшенням щільності струму відбуваються послідовне освіту і розпад на поверхні вищих нестійких окислів РtO2. РtO3. РtO4. що визначає ступінчастий характер h-lgi прямих і дуже високі значення перенапруги виділення кисню, що досягають при 1 А / см 2 1,38 В.
Для всіх електродів з газовиділенням характерний так званий "анодний ефект". Він проявляється в різкому підвищенні опору на кордоні розділу анод-електроліт, що приводить до збільшення напруги на електролізері на 10-100 В, появи іскрового розряду в пріанодном шарі.
Причини появи анодного ефекту неоднозначні. Ними можуть бути поверхневі плохопроводящіе з'єднання типу CFn. СCln. CBrn і т.д.
Іншою причиною може виявитися газогідродінаміческая НЕ-стійкість, що виникає, коли зі збільшенням анодної щільності струму до критичної газоподібні продукти не встигають вийти з пріанодном зони, обволікають анод. Виникає при цьому газова плівка володіє в порівнянні з електролітом істотно великим опором і є причиною анодного ефекту. Остання трактування знаходить підтвердження в залежності величини критичної густини струму від смачиваемости анода електролітом. Чим краще змочуваність, тим вище Iкр.
Анодне розчинення металів по реакції
Me - nе = Ме n + (3.58)
супроводжується або електрохімічної, або концентраційної поляризацією. Переважає, як правило, той же вид поляризації, який є переважаючим і для катодного процесу.
При електрохімічному контролі величина поляризації пов'язана з щільністю струму рівнянням Тафеля
При дифузійному контролі - рівнянням концентраційної поляризації:
При цьому концентрація іонів розчиняється металу в приелектродному шарі (cs) зростає прямо пропорційно зі збільшенням щільності струму відповідно до рівняння
Після досягнення межі розчинності солі металу в електроліті на поверхні анода утворюється плівка твердої солі, що утрудняє відведення продуктів електролізу в обсяг електроліту, різко збільшує опір і падіння напруги в електроліті, що знижує струм електролізу. Це явище носить назву "сольовий пассивации".
При зміщенні потенціалів анода в область позитивних значень для ряду пасивуються металів створюються умови для освіти на їх поверхні тонких (2-10 мк), але досить щільних окисних плівок, пасивуючих анод, що перешкоджають проходженню струму електролізу і призводять до значної поляризації анода. Це явище носить назву "окисної пассивации" або просто "пассивации анода".
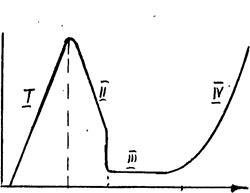
Прикладом є анодне розчинення заліза в розчинах H2 SО4 (рис.3.13)
Ріс.3.13.Від поляризаційних кривих для пасивуються металу (Fe в сірчанокислих розчинах): аб - область активного розчинення заліза з утворенням Fe 2+. Еф - фляде потенціал - потенціал переходу електрода в пасивний стан, відповідає реакції 2Fe + 3Н2 О-6Е = Fе2 О3 + 6Н +; bг - область пасивного стану (DЕ); гд - виділення на аноді О2.
Прикладом змішаної "сольовий" і "окисної" пассивации є анодне розчинення свинцю в сірчанокислих розчинах (рис.3.14).
1 область активного розчинення:
При Е = 0,356 В досягається ПР РbSO4. настає сольова пассивация (область П).
При = 0,615В досягається перехід анода в пасивний стан:
0,356 0, 615 1,23 E
Рис.3.14. Вид поляризаційних кривих при сольовий і окисної пассивации (Рb в сірчанокислих розчинах)
При 1,229 В досягаються потенціали виділення кисню по реакції Н2 О - 2е = 2Н + + 1 / 2О2 (область 1У).
Оскільки пассивация обумовлена появою на поверхні металу щільною окисної плівки, що надає виробу ряд цінних властивостей, то процес анодування виробів широко застосовується у виробничій практиці (антикорозійні, термостійкі покриття, грунтовка під фарбування, декоративні покриття і т.д.).
Однак при розчиненні і рафінуванні металів це явище вкрай небажано, оскільки призводить до різкого зменшення швидкості розчинення, значною поляризації анода, іонізації електропозитивних домішок, забруднення ними катодного металу. Для зменшення негативного впливу пасивації анода застосовують ряд прийомів:
1) використання реверсивного струму для перекладу і підтримки анода в області потенціалів активного розчинення (В.Г. Лобанов),
2) перепассівація анода, що приводить до утворення вищих оксидів, добре розчинних у електроліті. Наприклад, при великих перевантаженнях пасивуючий окисел Сr2 О3 переходить в добре розчинний біхромат СГ2 О7 2-,
3) введення в електроліт активаторів: Сl -. Вг -, I -. F - і т.д.
Активатори адсорбционно витісняють з поверхні електрода пассивирующие агенти, запобігаючи тим самим пасивацію анода.
Наприклад, хром в розчинах сірчаної кислоти знаходиться в пасивному стані і не взаємодіє з нею. Варто ввести в розчин NaCI, як починається бурхливий взаємодія хрому і сірчаної кислоти з виділенням водню.
Анодне розчинення сплавів (амальгам) додатково ускладнене концентраційної поляризацією з боку сплаву:
hспл = - ln. яка може бути розрахована за величиною граничного струму іонізації розчиняється з амальгами металу:
Вид поляризаційних кривих показаний на рис.3.15 для амальгам з різною концентрацією електроактивного металу (x1> x2> x3).
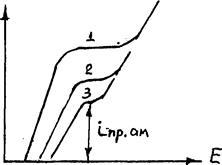
Рис.3.15. Вид поляризаційних кривих при розчиненні амальгам
В принципі все рафініруемого метали повинні розглядатися як складні сплави. Спочатку з них розчиняються електронегативні компоненти. Наприклад, для міді (Е ° = 0,337В) це Рb (E o Pb 2+ / Pb = -0,126B), Ni (-0,24 В).
Оскільки концентрація цих металів незначна, їх розчинення йде на граничному струмі разом з основним процесом - іонізацією міді.
У міру розчинення міді поверхневий шар збагачується за змістом електропозитивних елементів сріблом і золотом: Ag (E ° Ag + / Ag = 0,799В), Au (E ° Au + / Au = 1,7В). При дотриманні технології потенціали іонізації цих металів не досягаються, і вони фарбували з анода, переходячи в шлам.
Однак при значній поляризації анода (за рахунок пасивації або досягнення inp розчинення міді зі сплаву) через великий вміст Ag, Au може наступити іонізація благородних металів, що збільшить їх втрати з катодного міддю (рис.3.16).
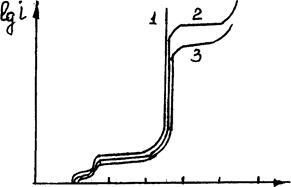
0 0,24 0,48 0,72 0,96 E, B
Рис.3.16. Вид поляризаційних кривих чорнової міді з різними добавками срібла: 1 - чорнової міді;
2 - чорнової міді з добавкою 10% Ag; 3-c добавкою 20% Ag
Контроль потенціалу є контролем дотримання технології, контролем якості одержуваного металу, контролем забезпечення необхідних економічних показників.