Визначення відновлюють цукрів по Бертрану - агроархів сільськогосподарські матеріали
Сахара, що мають вільні альдегідні або кетони групи, мають здатність в певних умовах відновлювати лужні розчини окису міді до закису, яка може бути врахована ваговим або об'ємним шляхом. Метод дає хороші результати при вмісті глюкози в випробуваному розчині в кількості від 10 до 90 мг. Слід уникати одночасного наявності в розчинах амонійних солей, амінокислот і пептонов, що сприяють переводу осаду закису міді в розчинний стан. Виключено застосування тріхлор- оцтової кислоти для очищення від білків, оскільки в умовах досвіду закис міді окислюється зазначеної кислотою.
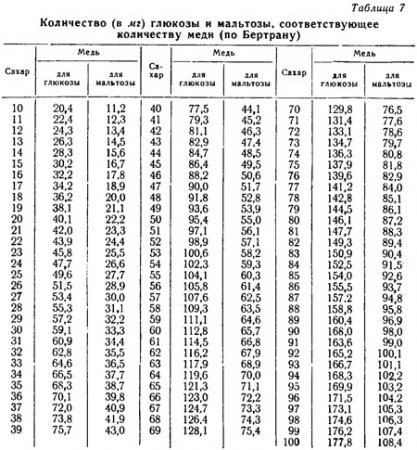
Метод Бертрана застосуємо для визначення глюкози, фруктози, галактози, манози, сорбози, пентози, Арабіноза, діоксіацетон так само, як і для інвертного цукру - мальтози і лактози. Для кожного із зазначених сполук є спеціальні таблиці, в яких дано кількісні співвідношення між відновленої міддю і цукром.
При визначенні цукрів з випробуваного матеріалу необхідно видалити білки і ряд інших, що заважають визначенню речовин. З цією метою додають розчини важких металів, наприклад солей ртуті, оцтовокислого свинцю, реактиву Барнштейна (розчини мідного купоросу і луги), гідрату окису цинку, гідрату окису кадмію та ін.
Принцип методу заснований на здатності окису міді в лужному середовищі окислювати альдегідні сполуки з утворенням червоного осаду закису міді. При цьому закис міді при наявності сірчаної кислоти окислюється окісним сірчанокислим залізом, яке при цьому відновлюється
Кількість відновленого заліза враховується титруванням розчину перманганату
З цих рівнянь випливає, що при перекладі закису міді 1 атом міді відповідає 1 атому заліза; на 10 атомів заліза доводиться 2 молекули перманганату, т. е. на 10 атомів заліза доводиться 2 молекули перманганату, а на 10 атомів міді (635,6 г) також йде 2 молекули перманганату (360,8 г) або 1 мл КМnO4 відповідає 2 , 01 мг міді. Знаючи кількість КМnO4, витраченого на визначення, обчислюють кількість міді.
Необхідні реактиви.
1. 40 г чистої перекристалізованої сірчанокислої міді (CuSO4) розчиняють в дистильованої воді до 1 л; в разі потреби розчин фільтрують через паперовий фільтр.
2. 200 г сегнетової солі (подвійна сіль виннокислою солі калію натрію) С4Н4O6КNа • 4Н2O і 150 г їдкого натрію розчиняють в дистильованої воді і об'єм доводять до 1 л. Якщо розчин каламутний, його потрібно відфільтрувати, але через азбестовий фільтр і по можливості швидко.
Розчини (1, 2) змішують навпіл безпосередньо перед визначенням цукрів. На кожне визначення беруть по 20 мл 1-го розчину і до нього доливають стільки ж мілілітрів 1-го розчину (розчин Фелінга). Дотримання цих співвідношень є неодмінною умовою роботи.
Розчин оксидів заліза готується по одній з двох модифікацій:
а) 50 г Fe2 (SO4) 3 і 200 г (108 мл) концентрованої сірчаної кислоти обережно змішують з дистильованою водою і доводять до 1 л. Розчин не повинен мати відновлює характером, тому до отриманого розчину додають по краплях перманганат до появи незникаючого, але дуже слабкого рожевого відтінку;
б) замість сернокислой окису заліза можна взяти 86 г железоамміачних квасцов (Fe2 (NH4) 2 (SO4) 4 • 24Н2O), 200 г концентрованої сірчаної кислоти і води до 1 л.
3. 5 г марганцевокислого калію розчиняють в 1 л дистильованої води. При зазначеної концентрації перманганату кожному мілілітр розчину відповідає округлено 10 мг міді. При використанні 0,1-н. розчину перманганату (3,16 г КМnO4 в 1 л) кожному мілілітр відповідає 6,36 мг міді.
При приготуванні розчину перманганату зручно користуватися його фіксанали, 1 мл якого відповідає 6,357 мг міді.
Визначення. Беруть піпеткою 5-10 мл досліджуваного розчину, в залежності від очікуваного вмісту цукру, в колбу на 200 мл. Кількість цукру в пробі повинно бути не менше 10 і не більше 100 мг. До розчину доливають 40 мл свежеприготовленной суміші Фелінга, змішують і швидко нагрівають до кипіння, яке підтримують рівно протягом 3 хв. Відлік часу проводять за допомогою пісочного годинника, починаючи з моменту появи пухирців. Рідина після кипіння повинна мати синій колір, що свідчить про надлишок сірчанокислої міді. Якщо синє забарвлення відсутнє, беруть більше 100 мг цукру і визначення повторюють з меншою кількістю досліджуваного розчину.
Після закінчення кипіння колбу знімають з вогню, дають утворився осадку закису міді відстоятися і, з'єднавши відсмоктувати колбу з насосом, рідина обережно зливають по паличці на фільтр через один і той же місце краю колбочки. Для фільтрування використовують скляні фільтри Шотта № 3, поверх пластинки поміщають шар волокнистого азбесту. Осад закису міді намагаються не переносити на фільтр, оскільки вона утворює на фільтрі щільний шар, насилу піддається подальшого розчинення. Після того як синя рідина відфільтрована, що залишився в колбі осад промивають струменем гарячої свежепрокипяченной води, яку також зливають на фільтр, але не до кінця, залишаючи над закисом міді невелика кількість води, щоб уникнути зіткнення з повітрям. Промивання водою виробляють до зникнення лужної реакції на лакмус, причому ретельно промивають струменем води стінки колби і фільтра. Після цього з приймальні колби виливають фільтрат разом з промивними водами, споліскують колбу дистильованою водою і знову вставляють в неї фільтр. До осадку закису міді доливають для розчинення 5-10 мл розчину окисного заліза, ретельно споліскуючи їм стінки колби, і розчин яскраво-зеленого кольору зливають на фільтр. Колбу ще раз споліскують 5-10 мл розчину окисного заліза, зливаючи знову на фільтр. Слід домогтися повного розчину осаду, але не оголювати його, причому поверхневий шар азбесту на фільтрі можна злегка скаламутити. Колбу і фільтр після цього ретельно промивають кілька разів невеликими порціями свежепрокипяченной води, споліскуючи спочатку колбу, а потім фільтр до зникнення в промивних водах кислої реакції на лакмус. Коли вся розчинена закис міді буде зібрана в приймальні колбі, приступають до негайного титрування утворилася закису заліза розчином перманганату. Перехід забарвлення рідини при титруванні з зеленого кольору в рожевий вельми виразний.
Титр перманганату, виражений в міліграмах міді, т. Е. Рівний 6,357 мг, множать на кількість мілілітрів перманганату, який пішов на титрування досліджуваного розчину. Так визначають кількість міді, яка брала участь в реакції. За даними табл. 7 знаходять, якій кількості цукру відповідає отримане нами кількість міді.