Випаровування і конденсація
Випаровування - це процес перетворення рідини в пар.
У рідини (або твердому тілі) при будь-якій температурі існує деяка кількість «швидких» молекул, кінетична енергія яких більше потенційної енергії їх взаємодії з іншими частинками речовини. Якщо такі молекули виявляються поблизу поверхні, то вони можуть подолати тяжіння інших молекул і вилетіти за межі рідини, утворюючи над нею пар. Випаровування твердих тіл також часто називають сублімацією або сублімацією.
Випаровування відбувається при будь-якій температурі, при яких дана речовина може перебувати в рідкому або твердому станах. Однак інтенсивність випаровування залежить від температури. При підвищенні температури кількість «швидких» молекул збільшується, і, отже, інтенсивність випаровування зростає. Швидкість випаровування також залежить від площі вільної поверхні рідини від виду речовини. Так, наприклад, вода, налита в блюдце, випарується швидше води, налитої в склянку. Спирт випаровується швидше води і т.д.
конденсація
Кількість рідини у відкритій посудині внаслідок випаровування безперервно зменшується. Але в щільно закритій посудині цього не відбувається. Пояснюється це тим, що одночасно з випаровуванням в рідини (або твердому тілі) відбувається зворотний процес. Молекули пара рухаються над рідиною хаотично, тому частина з них під дією тяжіння молекул вільної поверхні потрапляє назад в рідину. Процес перетворення пари в рідину називається конденсацією. Процес перетворення пари в тверде тіло зазвичай називають кристалізацією з пари.
Після того, як ми наллємо рідина в посудину і щільно його закриємо, рідина почне випаровуватися, і щільність пара над вільною поверхнею рідини буде збільшуватися. Однак, одночасно з цим буде рости число молекул, які повертаються назад в рідину. У відкритому посуді ситуація інша: покинули рідина молекули можуть не повертатися в рідину. У закритій посудині з плином часу встановлюється рівноважний стан: число молекул, що залишають поверхню рідини, стає дорівнює кількості молекул пара, які повертаються в рідину. Такий стан називається станом динамічної рівноваги (рис.1). У стані динамічної рівноваги між рідиною і парою одночасно відбувається і випаровування і конденсація, і обидва процеси компенсують один одного.
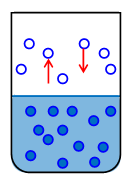
Рис.1. Рідина в стані динамічної рівноваги
Насичений і ненасичений пар
Насичена пара - це пара, що знаходиться в стані динамічної рівноваги зі своєю рідиною.
Назва «насичений» підкреслює, що в даному обсязі при даній температурі не може перебувати більшу кількість пара. Насичена пара має максимальну щільність при даній температурі, а, отже, чинить максимальний тиск на стінки посудини.
Ненасичений пар - пар, який не досяг стану динамічної рівноваги.
У різних рідин насичення пара відбувається при різних щільності, що зумовлено відмінностями в молекулярній структурі, тобто відмінністю сил міжмолекулярної взаємодії. У рідинах, у яких сили взаємодії молекул великі (наприклад, в ртуті), стан динамічної рівноваги досягається при невеликих щільності пара, так як кількість молекул, здатних залишити поверхню рідини, невелика. Навпаки, у летючих рідин з малими силами тяжіння молекул, при тих же температурах з рідини вилітає значна кількість молекул і насичення пара досягається при великій щільності. Прикладами таких рідин є етанол, ефір і ін.
Так як інтенсивність процесу конденсації пари пропорційна концентрації молекул пара, а інтенсивність процесу випаровування залежить тільки від температури і різко зростає з її ростом, то концентрація молекул в насиченому парі залежить тільки від температури рідини. Тому тиск насиченої пари залежить тільки від температури і не залежить від обсягу. Причому з ростом температури величина концентрації молекул насиченої пари і, отже, щільність і тиск насиченої пари швидко ростуть. Конкретні залежності тиску і щільності насиченої пари від температури різні для різних речовин і можуть бути знайдені з довідкових таблиць. При цьому виявляється, що насичений пар, як правило, добре описується рівнянням Клайперона-Менделєєва. Однак, при стисненні або нагріванні маса насиченого пара змінюється.
Ненасичений пар з достатнім ступенем точності підпорядковується законам ідеального газу.
Приклади розв'язання задач
У закритій посудині місткістю 0,5 л при температурі знаходяться в рівновазі пари води і крапля води. Визначити масу водяної пари в посудині.
У посудині об'ємом 1 л при температурі знаходяться в рівновазі вода, водяна пара і азот. Обсяг рідкої води багато менше обсягу судини. Тиск в посудині становить 300 кПа, атмосферний тиск 100 кПа. Знайти загальна кількість речовини в газоподібному стані. Яке парціальний тиск азоту в системі? Яка маса водяної пари? Яка маса азоту?
Запишемо рівняння Менделєєва-Клапейрона для газової суміші водяну пару + азот:
звідки знайдемо загальну кількість речовини в газоподібному стані:
Універсальна газова стала.
Переведемо одиниці в систему СІ: обсяг судини тиск в посудині температура.
Згідно із законом Дальтона, тиск в посудині дорівнює сумі парціальних тисків водяної пари і азоту:
звідки парціальний тиск азоту:
При температурі тиск насиченої пари дорівнює атмосферному, тому.
Запишемо рівняння Менделєєва - Клапейрона для водяної пари:
звідки маса водяної пари:
Молярна маса водяної пари.
Аналогічно знаходимо масу азоту:
Молярна маса азоту.
Загальна кількість речовини в газоподібному стані 0,097 моль; парціальний тиск азоту 200 кПа; маса водяної пари 0,58 г; маса азоту 1,8 м