Трансплантація тонкої кишки
Показання до трансплантації, особливості відбору реципієнтів
Трансплантація тонкої кишки розвивалася в світі з деяким запізненням порівняно з трансплантацією інших органів, однак до теперішнього часу стала визнаним методом лікування синдрому кишкової недостатності.
Синдром кишкової недостатності обумовлений нездатністю шлунково-кишкового тракту забезпечити водно-електролітний баланс і необхідний рівень абсорбції поживних речовин з огляду на різке зниження або відсутність ефективної площі всмоктування і пристінкового травлення. Особливо гостро проблема кишкової недостатності варто в педіатричній практиці в зв'язку з високими метаболічними потребами дитячого організму. Найбільш часті причини кишкової недостатності - захворювання, що призводять до видалення кишки, такі, як некротичний ентероколіт, странгуляційна кишкова непрохідність, хвороба Гіршпрунга, а у дітей - вади розвитку: атрезія, гіпоплазія кишечника, відсутність м'язової оболонки кишки і інші.
Вважають, що кишкова недостатність виникає при довжині тонкої кишки менше 40 см від зв'язки Трейтца.
У патогенезі кишкової недостатності переважають процеси мальабсорбції і енергетичної заборгованості клітин, які характеризуються формуванням абсолютного дефіциту ліпідів, гідрокарбонатів, білків, вітамінів та інших поживних речовин. Це призводить до низького рівня метаболізму, тотального дефіциту основних макроергічних з'єднань і різкого водно-електролітного дисбалансу. У клінічній картині захворювання переважає діарея.
Варіанти трансплантатів тонкої кишки
Тонкокишковий трансплантат отримують як в результаті посмертного донорства, так і від живого родинного донора. У складі мультиорганного вилучення у донора в стані смерті мозку тонку кишку забирають цілком, починаючи від зв'язки Трейца до термінального відділу клубової кишки, що відповідає басейнам верхньої брижової артерії та вени.
Світовий досвід родинного донорства при трансплантації кишки невеликий і нараховує кілька десятків спостережень. У той же час відсутність періоду очікування, хороша чи ідеальна гістосумісності пари донор-реципієнт і, як наслідок, суттєво менший ризик відторгнення при більш щадному режимі медикаментозної імуносупресії роблять споріднену трансплантацію кишки привабливою. Отримання тонкої кишки від живого донора має обмежуватися невеликою довжиною трансплантата, щоб не завдати шкоди здоров'ю донора. У зв'язку з цим представляється логічним використовувати живе (родинне) донорство тонкої кишки в педіатричній практиці, в основному у дітей перших років життя. Таким реципієнтам для компенсації кишкової недостатності можна імплантувати ділянку, що не перевищує 1 м, тоді як для дорослого реципієнта трансплантат повинен бути значно довшим, що небайдуже для здоров'я донора.
Ділянка кишки, що видаляється у живого донора в якості трансплантата, можна отримати в будь-якому місці худої або клубової кишки, що визначається варіантом кровопостачання, тобто наявністю добре сформованої судинної аркади, що живиться від однієї з гілок верхньої брижової артерії і має відтік в один венозний стовбур. Найчастіше цим умовам відповідає клубова кишка (рис. 69-14).
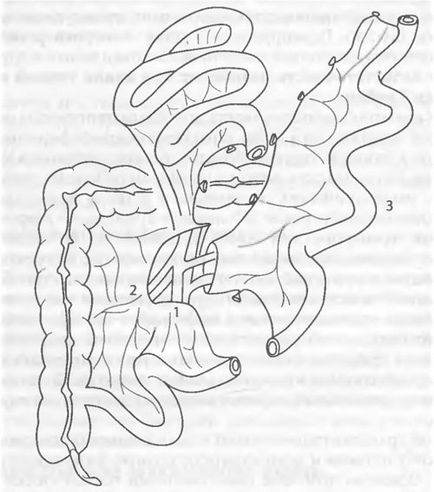
Мал. 69-14. Паркан біля живого (родинного) донора фрагмента тонкої кишки (схема): 1 - верхнебрижеечной артерія і вена; 2 - клубово-ободової артерія і вена; 3 - фрагмент клубової кишки, виділений для трансплантації.
Техніка трансплантації тонкої кишки
Для трансплантації тонкої кишки необхідний широкий лапаротомного доступ: у дорослих - серединна лапаротомія, а у дітей - поперечний субкостальная розріз. До моменту визначення показань до трансплантації тонка кишка вже видалена у зв'язку з основним захворюванням. У реципієнта виконують прецизионное поділ зрощень петель товстої кишки з черевної стінкою, виділення проксимальної і дистальної куксою тонкої кишки і підготовку посудин до анастомозірованія з судинами трансплантата.
Для реваскуляризації кишкового трансплантата можна використовувати будь-які артеріальні і венозні судини, накладення анастомозів з якими може забезпечити оптимальні умови для кровопостачання трансплантата - аорта вище чревного стовбура або нижче відходження ниркових артерій, клубові артерії, а також власне верхня брижова артерія реципієнта.
Для відновлення венозного відтоку можливо використовувати як портальний, так і системний дренаж, що залежить від конкретних умов імплантації. У світовій практиці трансплантації тонкої кишки відсутня статистично достовірна різниця результатів накладення порто-портального або порто-системного венозного анастомозів. Порто-портальний дренаж виконують анастомозірованія вени трансплантата з ворітної веною реципієнта ( «кінець-в-пліч»), з верхньої брижової веною реципієнта ( «кінець-в-кінець» або «кінець-в-пліч») або з областю злиття верхньої брижової і селезінкової вен реципієнта. Порто-системний дренаж здійснюють анастомозом вени трансплантата з нижньої порожнистої або клубовими венами реципієнта в будь-якому доступному місці.
Оскільки до складу трансплантата тонкої кишки входить брижі, перед накладенням судинних анастомозів необхідно переконатися у відсутності перекрутити брижі навколо осі. Для профілактики можливих подальших деформацій брижі доцільно окремими сіро-серозними швами фіксувати її в черевній порожнині в найбільш вигідному положенні.
Щоб створити оптимальні умови консолідації міжкишкових анастомозів і виключити застій кишкового вмісту в просвіті трансплантата, формують розвантажувальні стоми. Для цього проксимальний кінець трансплантата тонкої кишки виводять у вигляді кінцевий ентеростоми на передню черевну стінку, а проксимальний анастомоз з власним шлунково-кишковим трактом реципієнта виконують дистальніше «кінець-в-пліч». Дистальний анастомоз накладають або з куксою термінального відділу клубової кишки, або безпосередньо з товстою кишкою реципієнта «кінець-в-кінець» або «кінець-в-пліч» в залежності від анатомічної ситуації (рис. 69-16).
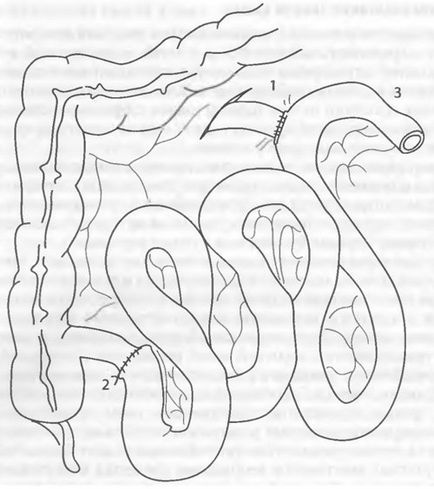
Мал. 69-16. Схема імплантації фрагмента тонкої кишки: 1 - анастомоз між худою кишкою реципієнта і проксимальним відділом трансплантованою кишки (кінець-в-бік); 2 - анастомоз між дистальним кінцем трансплантованою кишки і клубової кишкою реципієнта (кінець-в-кінець); 3 - проксимальний кінець трансплантата (виведений на передню черевну стінку у вигляді кінцевий ентеростоми).
Особливості ведення післяопераційного періоду, иммуносупрессивное лікування
Необхідна умова адекватного контролю реакції відторгнення трансплантата - ендоскопічне дослідження через ентерит, яке полягає в огляді стану слизової оболонки трансплантованою кишки і виконанні її біопсії. Через 3-4 тижні після операції при досягненні адекватного придушення трансплантаційного імунітету і відновлення функції шлунково-кишкового тракту ентерит закривають і починають ентеральне харчування. Такий період повного парентерального харчування після трансплантації тонкої кишки необхідний для ліквідації наслідків ішемічного пошкодження трансплантата, а також для загоєння ранових поверхонь кореня брижі і для профілактики лімфорею в черевну порожнину.
Імуносупресивну лікування проводять по чотирьохкомпонентної протоколу:- індукція імуносупресії гібридними (гуманізувати) моноклональними антитілами - Даклізумаб або Базіліксімаб;
- основний компонент підтримуючого лікування - інгібітор кальциневрину - такролімус, введення якого в практику трансплантології дозволило зробити трансплантацію тонкої кишки реальної;
- глюкокортикоїди, дози яких поступово зменшують;
- препарати мікофенолової кислоти.
Результати трансплантації тонкої кишки
У США протягом року виконують 120-130 трансплантацій тонкої кишки. Виживання кишкового трансплантата протягом 3 міс становить 87%, тоді як річне виживання - 77,1%. Через 3 роки функціонують 55,7%, а через 5 років - 47,5% трансплантатів. З реципієнтів тонкої кишки живуть 5 років тільки 53,5% хворих, які перенесли операцію. Такий низький рівень виживання реципієнтів тонкої кишки пояснюють проведенням потужного іммуноподавляющего лікування, що сприяє розвитку великої кількості інфекційних ускладнень і лімфопроліферативного синдрому.
Трансплантація тонкої кишки - операція, що рятує життя хворого, тому проблема виживання тонкокишечного трансплантата вельми актуальна. Для її вирішення ведуть активну розробку нових імуносупресорів і схем іммуноподавляющего лікування. У педіатричній практиці перспективно використання спорідненого донорства, що істотно полегшує проведення іммуноподавляющего лікування.