Технологія отримання етиленгліколю на основі гідратації оксиду етилену, публікація в журналі
Внастоящее час основним промисловим способом отримання етиленгліколю являетсягідратаціі окису етилену, в основі якої лежить наступна реакція:
Крім цього, окис етилену реагує з утворився моноетиленгліколю і його вищими гомологами з утворенням діетиленгліколю, триетиленгліколя та інших, вищих гликолей:
У промислових умовах застосовують отримання етиленгліколю некаталітичного гидратацией окису етилену, яка включає в себе наступні стадії: приготування вихідного водного розчину окису етилену в воді, гідратація окису етилену, упаривание водного розчину етиленгліколю і ректифікація розчину гликолей з виділенням товарних продуктів (моноетиленгліколю і побічно одержуваних ді- і триетиленгліколя) [3, с.112; 4, с.583].
На рис.1 показана технологічна схема виробництва етиленгліколю потужністю близько 3 т / год (Німеччина, Anorgana), де 1, 5, 9, 12, 13, 19-22 - збірники; 2, 4 - насоси; 3 - змішувачі; 6 - теплообмінник; 10, 23 - підігрівачі; 11, 17 - випарніапарати; 14-16, 18 - колони.
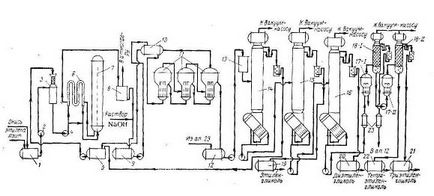
Мал. 1. Технологічна схема виробництва етиленгліколю
Попередньо окис етилену охолоджується до температури -10 ° С, після чого зі збірки 1 подається в змішувач 3. Верхня частина змішувача являє собою насадок колони, яка заповнена кільцями Рашига (15 * 15 мм). Основна функція її полягає в абсорбції парів окису етилену, які можуть виділитися при неповному поглинанні її водою в нижній частині змішувача.
Зі збірки 5 подається в верхню частину змішувача водяний конденсат з температурою близько 20 ° С, який отримано після випарювання і ректифікації слабкого розчину гліколю. При цьому співвідношення окису етилену і води необхідно підтримувати 1: 6 (за обсягом).
Шихта, що складається з 13% окису етилену, з змішувача 3, подається при тиску до 2,45 МПа в гидрататор 7 через теплообмінник 6. Шихта в теплообміннику 6 підігрівається реакційної рідиною, що виходить з гидрататор до 160-180 ° С, при цьому сама реакційна рідина охолоджується до 90 ° С.
Параметри роботи гидрататор:
робочий тиск 1,5-2,1 МПа,
температура 200-210 ° С (у верхній частині)
близько 180 о С (в нижній частині гидрататор).
Реакційна рідина, яка надходить з гидрататор, дросселируется і з неї виділяється частина газів - ацетальдегід, кротоновий альдегід та ін. Після чого надходить в розширювач 8. Потім рідину, в яку безперервно вводиться 30-відсотковий розчин лугу для підтримки рН на рівні 7-8, потрапляє в ємність 9.
Слабкий розчин гликолей з ємності 9 надходить на трехкорпусние випарну установку 11 через підігрівач 10. Підігрівач обігрівається вторинним паром, що виходять з останнього корпусу. Конденсат з підігрівача збирається в збірнику 5.
Розчин в першому корпусі нагрівається до 214 ° С парою 2,1 МПа. Виходить з цього корпусу пар тиском 0,8-0,9 МПа і температурою 170 ° С надходить на обігрів другого корпусу. Другий корпус працює при тиску 0,3-0,4 МПа. і розчин в ньому нагрівається до 170 ° С; пари води з цього корпусу з температурою 129 ° С надходять на обігрів третього корпусу. Останній працює при тиску 66,7 кПа, і виходить з нього сирий концентрований гліколь містить 5-15% води; він збирається в збірнику 12.
У збірнику 5 збирається дистилят колони 14, який використовується для приготування водно-оксидної шихти. Зневоднений гліколь-сирець з куба колони 14 з температурою 145 ° С подається насосом в колони 15 (в схемі передбачені дві колони) для отримання етиленгліколю-ректифікату. Ректифікація проводиться при залишковому тиску 0,7 кПа вгорі колони, що відповідає температурі 80 ° С. Товарний етиленгліколь збирається в збірнику 19. Кубова рідина колони 15 з температурою 195 ° С насосом подається в колону 16 діаметром 1600 мм. Колона має 33 тарілки, відстань між ними 333 мм. Харчування подається на 6, 8, 10, 12 м 14 тарілки, вважаючи знизу.
Товарний діетиленгліколь відбирається в збірнику 20 зверху колони (залишковий тиск 0,5 кПа). Кубовий залишок колони 16 направляють на склад і, в міру накопичення, переробляють на двох послідовно працюючих насадок колонах 18 при залишковому тиску 0,7 кПа.
діаметр колон 800 мм;
насадка - кільця Рашига 50 * 50 мм висотою шару 3,5 м.
Кожна колона має нагрівальний змійовик і по два виносних випарних апарату 17, обігріваються паром з тиском 2,1 МПа.
Кубова рідина колони 16 подається перший випарної апарат 17 через підігрівач 23, з якого пари гликолей надходять в колону 18-1. Дистилят цієї колони, що містить деяку кількість діетиленгліколю, повертається до збірки 12 концентрованого гліколю-сирцю, а триетиленгліколь в суміші з більш високомолекулярними гликолями з нижньої частини колони насосом подається в другій випарної апарат 17. Пари з цього апарату надходять в другу колону 18-11, дистилят якої є товарним триетиленгліколя і збирається в збірнику 21. Кубові залишки колони 18-11 - технічний тетраетіленгліколь збирається в збірнику 22. Випарніапарати 17 працюють періодично. Перед зливом полигликолей апарати продувають водяною парою (для отдувки залишків три- і тетраетіленгліколей).
Практично вся апаратура описаної установки для отримання етиленгліколю була виготовлена з вуглецевої сталі. Вакуум в колонах створювався індивідуальними паро-Ежекційна установками. На такій установці з двома паралельно працюючими гидрататор (один - внутрішнім діаметром 810 мм і другий - 760 мм) переробляли 2500 кг / год окису етилену і отримували 3197 кг / год гликолей, в тому числі: етиленгліколю - 2830 кг (88,5%) , діетиленгліколю - 296 кг (9,3%) і триетиленгліколя - 71 кг (2,2%). Сумарний вихід гликолей становить від 92,5 до 95-96% від теоретичного [2, с.84].
Головною перевагою процесу рідкофазної гідратації окису етилену є практично повна конверсія окису етилену. Однак, існує ряд недоліків, а саме: некаталітичні гідратація здійснюється при підвищеному тиску; при кислотному каталізі реакційна апаратура повинна виготовлятися з матеріалів, стійких до агресивної дії розбавлених кислот, крім того, потрібна додаткова апаратура для нейтралізації кислоти і для виведення з системи утворюються солей; великі енергетичні витрати при концентруванні розбавлених розчинів етиленгліколю.
Передбачалося, що гідратація окису етилену в паровій фазі над твердими каталізаторами дозволить усунути недоліки рідкофазної гідратації.
Ефективним каталізатором гідратації виявилася окис срібла, нанесена па окис алюмінію: при ступеня конверсії окису етилену, що дорівнює 22-24%, селективність перетворення її в гліколь склала близько 80%. При збільшенні ступеня конверсії до 40% селективність знижувалася до 40%.
При використанні каталізатора цеолітів (температура від 30 до 150 ° С, мольное відношення води до окису етилену, що дорівнює 10: 1) вихід етиленгліколю становить 90,5% при ступені конверсії окису етилену лише 11,3%. Якщо підвищувати ступінь конверсії окису етилену до 17-24%, знижується вихід етиленгліколю до 78-69%.
Якщо в процесі Парофазная гідратації окису етилену використовувати каталізатор катионит амберліт (температура від 115 до 200 ° С, тиск від 0,14 до 0,55 МП, мольном щодо парів води і окису етилену від 5 до 2) реакція протікає з великою швидкістю (час контакту - соті і десяті частки секунди). При температурі 160-165 ° С і мольному відношенні води до окису етилену, що дорівнює 20: 1, вихід етиленгліколю досягає 89% при ступені конверсії окису етилену близько 14%. При відношенні води до окису етилену, що дорівнює (5-10): 1, вихід етиленгліколю становить 80-85%, а ступінь конверсії окису етилену - максимум 17%.
Існує ряд недоліків в процесі гідратації окису етилену в паровій фазі. По-перше, при використанні каталізаторів цеолітів і катионитов висока селективність досягається при великому співвідношенні парів води, окису етилену і дуже низького ступеня конверсії окису етилену. Висока селективність і конверсія при малому відношенні води до окису етилену виходять при проведенні процесу парофазного гідратації окису етилену в псевдозрідженому шарі змішаного фосфатного каталізатора (фосфатів кальцію і міді). Однак час контакту вельми тривалий, і тому в промислових умовах використання неможливо, це зажадає більшої кількості каталізатора і реакторів значного обсягу. По-друге, відсутні дані по механічної міцності і стабільності каталізатора, що не дозволяє судити про практичну можливість його використання.
Необхідно враховувати здатність окису етилену до полімеризації під впливом різних речовин, тому можна вважати, що активність гетерогенних каталізаторів в міру їх експлуатації буде знижуватися через відкладення на них продуктів полімеризації або ізомеризації окису етилену. Саме з цієї причини в науковій літературі відсутні інформація про здійснення процесу парофазного гідратації окису етилену в промислових умовах.
1. ГОСТ 19710-83. Етиленгліколь. Технічні умови. - М. Изд-во стандартів, 1983. - 15 с.
2. Димент О. Н. Казанський К. С. Мірошников А. М. Гликоли і інші похідні окисів етилену і пропилену - М. Хімія, 1976. - 372 c. (84)
3. Казарновський С. Н. Козлов В. Н. Альбом технологічних схем процесів основного органічного синтезу: навч. допомога. Горького. політехн. ін-т ім. А. А. Жданова. - Горький: 1958. - 123 с.
4. Юкельсон І. І. Технологія основного органічного ситезу: навч. для хіміко-технологічних спеціальностей. - М. Хімія, 1968. - 846с. мул.
Основні терміни (генеруються автоматично). окису етилену, гідратації окису етилену, конверсії окису, ступеня конверсії окису, Парофазная гідратації окису, ступінь конверсії окису, гідратація окису, рідкофазної гідратації окису, водного розчину окису, процесі гідратації окису, Кубова рідина колони, абсорбції парів окису, співвідношення окису, некаталітичного гидратацией окису, вихід етиленгліколю, повна конверсія окису, залишковому тиску, ізомеризації окису, здатність окису, виробництва етиленгліколю.
Ключові слова
етиленгліколь, окис етилену, реакція гідратації, поліефірні волокна, параметри процесу