Щільність спирту, значення і приклади завдань
Метанол, етанол і пропанол змішуються з водою у всіх співвідношеннях. З ростом молекулярної маси розчинність спиртів у оді різко падає. Вищі спирти практично не розчинні у воді.
Нижчі спирти володіють характерним алкогольним запахом, запах середніх гомологів сильний і часто неприємний. Вищі спирти практично не мають запаху. Третинні спирти володіють особливим характерним запахом плісняви.
Нижчі гліколі - в'язкі безбарвні рідини, що не мають запаху; добре розчинні у воді і етанолі, мають солодкий смак.
Спирти мають аномально високими температурами кипіння в порівнянні з представниками таких класів органічних сполук, як алкани, галогеналкани, Меркаптани, аміни. Наприклад, температура кипіння етанолу 78 o. тоді як хлоретану - 13 o С, а етану - 88,5 o С. Ці відмінності пояснюються особливостями будови спиртів.
Хімічний склад і щільність спирту
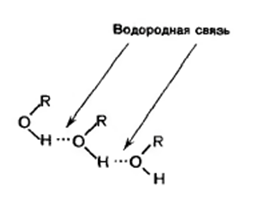
Атом кисню в молекулі спирту має велику електронегативність і відтягує на себе електронну щільність s-зв'язків пов'язаних з ним атомів, зокрема атома водню. Зв'язок O-H в молекулі спирту сильно поляризована на R → O ← H. Електронна щільність на атомі водню виявляється зниженою. Тому він може взаємодіяти з неподіленої парою електронів атома кисню іншої молекули спирту. Між двома молекулами виникає Нековалентні воднева зв'язок (графічно водневу зв'язок прийнято зображати точками). Молекули, пов'язані між собою водневими зв'язками, утворюють асоціати: