Резистентність мікроорганізмів, обумовлена бета-лактамазами, і способи її подолання,
Резистентність мікроорганізмів, обумовлена бета-лактамазами, і способи її подолання
В даний час бета-лактамні антибіотики є найбільш часто вживаними препаратами для лікування бактеріальних інфекцій, однак їх ефективність може знижуватися внаслідок виникнення до них стійкості, найбільш частим механізмом розвитку якої є продукція бета-лактамаз. Для подолання даного специфічного механізму резистентності були синтезовані інгібітори бета-лактамаз, здатні пригнічувати активність широкого ряду бета-лактмаз, що виробляються грампозитивними, грамнегативними і анаеробними патогенами. У даній статті будуть розглянуті механізм дії і спектр активності одного з найбільш часто вживаних інгібіторозахищених бета-лактамів - амоксицилін / клавуланату.
Сімейство бета-лактамних антибіотиків включає чотири основні групи антимікробних препаратів: пеніциліни, цефалоспорини, монобактами і карбапенеми.
Бета-лактамні антибіотики діють на клітину бактерії двома основними шляхами. По-перше, вони вбудовуються в стінку бактеріальної клітини і пригнічують активність ферменту транспептидази, що бере участь в завершальному етапі побудови стінки бактерії. По-друге, вони зв'язуються з пеніцилінзв'язуючими білками (ПСБ), які в нормі пригнічують гідролази бактеріальної клітини і таким чином вивільняють ці гідролази, що призводить до лізису бактеріальної стінки. Для боротьби з цими основними механізмами дії бета-лактамів бактерії придбали здатність виробляти спеціальні ферменти бета-лактамази, здатні гідролізувати бета-лактамні кільце, а також змінювати тип будови ПСБ [1].
Синтез бета-лактамаз кодується або хромосомами (конститутивний тип), наприклад Pseudomonas aeruginosa, або плазмідами (індуцібельний тип), наприклад Aeromonas hydrophila і Staphylococcus aureus. Плазміди можуть передаватися від однієї бактерії до іншої, сприяючи швидкому поширенню резистентності.
Механізм дії бета-лактамаз
Бета-лактамазні ферменти руйнують бета-лактамні кільце двома основними механізмами. Перший механізм, властивий лактамазам класів А, С і D (розподіл на класи проводиться в залежності від послідовності амінокислот у структурі ферменту), полягає в зв'язуванні з субстратом завдяки наявності спеціального гнучкого активної ділянки (рис. 1). Відбувається необоротне зв'язування з вуглецем карбонільної групи бета-лактамних кільця і порушення його цілісності, що переводить антибіотик в неактивний стан і попутно забезпечує регенерацію бета-лактамази. Ці класи бета-лактамаз активні щодо багатьох пеніцилінів, цефалоспоринів та монобактами. Другий механізм притаманний менш поширеною групі бета-лактамаз, які відносяться до класу В. Ферменти цього класу називаються також метало-бета-лактамазами, оскільки містять рухливий двовалентний іон металу, найчастіше іон цинку, який здатний зв'язуватися з карбонільної групою більшості пеніцилінів, цефалоспоринів та карбапенемів, але не монобактами [1].
Класифікація бета-лактамаз
Починаючи з 60-х років XX століття пропонувалося кілька класифікацій бета-лактамаз, виходячи з їх біохімічних і функціональних особливостей і відмінностей в молекулярній будові (табл. 1) [3-5].
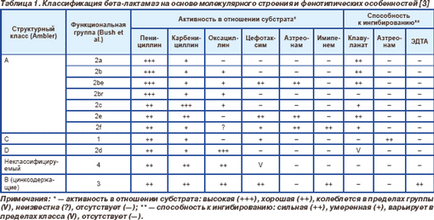
Більшість клінічно значущих бета-лактамаз належать до класів А і С. Зокрема, клас А включає хромосомні бета-лактамази Klebsiella spp., Citrobacter diversus. Proteus vulgaris і більшість Bacteroides spp. а також практично всі плазмідні бета-лактамази. Клас С містить хромосомні цефалоспорінази AmpС, клас В - ферменти Оха, які широко поширені в плазмидах Enterobacteriaceae. Клас В містить, як уже згадувалося раніше, кілька бета-лактамаз, що мають іон цинку [3].
Хромосомні бета-лактамази присутні в бактеріях спочатку, ще до створення антибіотиків (АБ): вони беруть участь у метаболізмі мікробної клітини, а також захищають бактерії від бета-лактамаз, що виробляються в природних умовах грибками. Однак в даний час основним фактором відбору штамів - продуцентів бета-лактамаз є використання бета-лактамних АБ, які сприяють штучному відбору бактерій за наступними напрямками: 1) продукування більшої кількості бета-лактамаз; 2) наявність додаткових бета-лактамаз, що кодуються плазмідами; 3) мутація наявних бета-лактамаз з розширенням їх спектру активності. Такий штучний відбір сприяв селекції цілих видів або окремих штамів бактерій - продуцентів бета-лактамаз, причому процес відбору з виробленням нових бета-лактамаз відбувався паралельно створенню нових антибактеріальних препаратів, метою якого була наявність стійкості до бета-лактамаз. Подолання даного механізму резистентності бактерій здійснювалося за двома напрямками: хімічна модифікація антибіотиків і комбінування бета-лактамів з інгібіторами бета-лактамаз.
Першим збудником, яка придбала здатність продукувати бета-лактамази, стали стафілококи: якщо в 1944 році бензилпенициллин був активний відносно 95% штамів Staphylococcus aureus. всього 5% штамів виробляли бета-лактамази і були до нього стійкі, то через 5 років питома вага бета-лактамазопродуцирующих штамів зріс до 50%, а через роки - до 90% за рахунок передачі генів і селекції стійких штамів. Створення в 60-і роки XX століття метициллина і оксациллина, стійких до стафілококовим бета-лактамаз і досі зберігають свою клінічну ефективність щодо метіцілліночувствітельних штамів, може служити прикладом підходу, спрямованого на хімічну модифікацію АБ [6].
Згодом проблеми стійкості до АБ, зумовленої продукцією бета-лактамаз, торкнулися більшою мірою грамнегативні палички, що пов'язано в значній мірі з розробкою нових АБ (табл. 2) [3]. Деякі грамнегативнібактерії мали природну стійкість до бета-лактамів внаслідок продукції великої кількості хромосомних бета-лактамаз: Klebsiellа spp. стійка доамінопеніцилін (ампіцилін, амоксицилін) і карбоксіпеніціллінам (карбеніцилін і тикарцилін). Однак у міру впровадження бета-лактамних АБ, активних щодо грамнегативної флори, клінічне значення придбали мікроорганізми, які мають придбану стійкість за рахунок синтезу індуцибельних бета-лактамаз класу А (P.vulgaris, C.diversus) і індуцибельних бета-лактамаз AmpC (Enterobacter spp . Citrobacter freundii. Morganella morganii. Providencia spp. Serratia spp. Pseudomonas aeruginosa), що забезпечило їм стійкість до амінопеніцилінів і цефалоспоринів I покоління. Найбільш клінічно важливим наслідком застосування бета-лактамів, активних щодо грамнегативної флори, стало поширення плазмідних бета-лактамаз, переважно ТИМ-1, серед видів, початково чутливих до цих АБ. В даний час до 60% штамів Enterobacteriaceae продукують цей тип бета-лактамаз, частота якого перевищує частоту всіх інших типів (ТЕМ-2, SHV-1, OXA-1) більш ніж в 10 разів. З середини 70-х років бета-лактамаза ТИМ-1 поширилася і на інші грамнегативні палички, псевдомонади і Vibrio cholerae. Цей тип ферменту залишається єдиним представником плазмідних бета-лактамаз у гонококів, виявляючись у 1-40% його штамів. Цей же фермент продукують 2-40% штамів Haemophilus influenzae в залежності від географічного регіону і капсулярного типу, причому його частота перевищує частоту іншого типу бета-лактамази даного мікроорганізму (ROB-1) в 10 разів. І тільки у псевдомонад і Moraxella catarrhalis ТИМ-1 втрачає свою першість, поступаючись його PSE-1 і PSE-4 у псевдомонад і BRO-1, BRO-2 у М.сatarrhalis. В даний час понад 80% штамів М.сatarrhalis продукують бета-лактамази. Всі перераховані вище бета-лактамази (TEM-1, TEM-2, SHV-1, PSE-1, PSE-4, BRO-1, BRO-2) належать до класу А, забезпечуючи подібний рівень стійкості до амино-, карбокси-, уреідо- і піперазінпеніціллінам, а також цефалоспоринів I покоління [7].
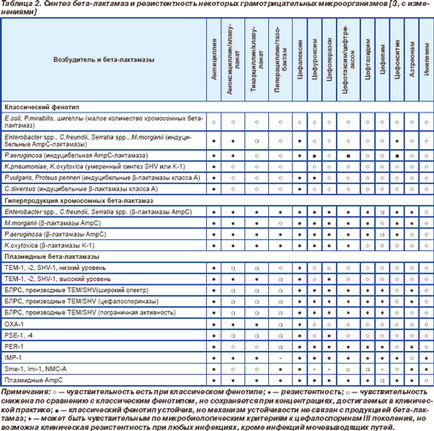
Після створення нових поколінь цефалоспоринів стійкість до них з'явилася у Enterobacte r spp. C.freundii. Serratia spp. M.morganii. P.aeruginosa внаслідок посиленого синтезу (гіперпродукції) бета-лактамаз AmpC, причому частота таких штамів в деяких країнах Європи досягає 70%. Пізніше цей фермент був виявлений у E.coli і Klebsiella spp.
В середині 80-х років XX століття були виявлені бета-лактамази розширеного спектру (БЛРС), більшість з яких з'явилося внаслідок мутацій ферментів типу TEM-1, TEM-2, SHV-1. Найчастіше ці бета-лактамази зустрічаються у Klebsiella spp. [8].
Карбапенеми володіють найбільшою серед всіх бета-лактамів стійкістю до всіх плазмідних бета-лактамаз класів А, С і D. Однак у даний час відзначається вироблення нових бета-лактамаз, переважно класу С, здатних инактивировать карбапенеми. З них найбільше значення мають ферменти, що виробляються Stenotrophomonas maltophilia. і широке використання карбапенемов може сприяти подальшій селекції цього штаму. Також побоювання викликає поява у Enterobacteriaceae. P.aeruginisa, Serratia marcescens, K.рneumoniae плазмідної ферменту класу В (IMP-1), який забезпечує стійкість до всіх бета-лактамних антибіотиків, крім монобактами [9].
Найбільш ефективною стратегією, спрямованої на подолання специфічного механізму резистентності, обумовленого продукцією бета-лактамаз, зараз є використання інгібіторозахищених бета-лактамів. Їх широкий спектр активності обумовлений здатністю інгібіторів инактивировать широке коло бета-лактамаз, що виробляються грампозитивними, грамнегативними та анаеробними мікроорганізмами.
І хоча вони не є надійним засобом щодо бета-лактамаз розширеного спектру, їх застосування замість цефалоспоринів сприяє зниженню селекції продуцентів цього типу бета-лактамаз.
Інгібітори бета-лактамаз є бета-лактамні структури, які необоротно зв'язуються з ферментами, самі при цьому руйнуючись, внаслідок чого вони отримали назву суїцидних інгібіторів. В даний час клінічне значення мають три таких інгібітора: клавулановая кислота (клавуланат) і два похідних пеніциланової кислоти - сульбактам та тазобактам.
Всі інгібітори бета-лактамаз інактивують більшість бета-лактамаз класу А, особливо хромосомні ферменти Bacteroides spp. C.diversus, Klebsiella spp. P.vulgaris. стафілококові пеніцилінази, а також бета-лактамази TEM і SHV - класичні та розширеного спектру (табл. 3) [3]. Однак активність клавуланата і тазобактама щодо ТЄМ-ферментів майже в 10 разів перевершує активність сульбактаму. Клавуланат і похідні пеніциланової кислоти також активні щодо деяких бета-лактамаз класу D, активність щодо класу С у них низька або відсутня.

Клавуланат був першим інгібітором бета-лактамаз, які мають клінічне застосування. Він має високу активність відносно бета-лактамаз класу А, особливо хромосомних бета-лактамаз Bacteroides spp. C.diversus, Klebsiella spp. P.vulgaris. P.mirabilis, Moraxella catarrharalis, стафілококових пеніциліназ, а також бета-лактамаз TEM і SHV, які часто виробляються представниками сімейства Enterobacteriaceae. Haemophilus influenzae. Neisseria gonorrhoeae. Хоча спостерігається зростання стійкості, обумовленої продукцією бета-лактамаз, більшість клінічно значущих бета-лактамаз зберігає свою чутливість до клавуланату (табл. 2) [3].
Клавуланат також проявляє власну антибактеріальну активність відносно грампозитивних і грамнегативних бактерій, а також анаеробів, причому механізм цієї активності не пов'язаний з пригніченням бета-лактамаз (табл. 4) [10]. Найменшу активність клавуланат проявляє щодо Pseudomonas aeruinоsa і ентерококів, більш виражену - у відношенні Enterobacteriaceae і H.influenzae, найбільшу - щодо Bacteroides fragilis і інших анаеробів, M.catarrhalis. стафілококів і стрептококів. Клавуланат також проявляє активність відносно Neisseria spp. і демонструє хорошу активність щодо таких атипових бактерій, як Chlamydia spp. і Legionella spp. [10].

Активність клавуланата досліджувалася в комбінації з іншими антимікробними препаратами, включаючи тикарциллин і пеніцилін, однак оскільки амоксицилін / клавуланат є найбільш часто застосовується комбінацією, більшість досліджень вивчало активність клавуланата саме в комбінації з амоксициліном.
З клінічної точки зору інтерес представляє антіпневмококковой активність амоксицилін / клавуланату, оскільки спостережуваний в деяких регіонах зростання резистентності Staphylococcus pneumoniae викликає серйозні побоювання. Дослідження in vitro показали, що клавуланат може підвищувати антіпневомококковую активність бета-лактамних антибіотиків завдяки додатковому зв'язування з ПСБ. Наприклад, додавання клавуланата знижує мінімальну переважну концентрацію (МПК) пеніциліну на 1/3, а пеніциліностійких штами пневмокока в його присутності змінюють форму і обсяг мікробних клітин. Таким чином, додаткове зв'язування з ПСБ надає амоксицилін / клавуланату більш виражену в порівнянні з амоксициліном антіпневмококковой активність [10].
Клавуланат також має високу активність in vitro щодо Legionella pneumophila. причому синергізм між клавауланатом і амоксициліном щодо цього патогена обумовлений не стільки бета-лактамазні активністю клавуланата (легионелла продукує бета-лактамази з низькою активністю), скільки додатковим зв'язуванням клавуланата і амоксициліну з ПСБ. Завдяки більш вираженою в порівнянні з пеніцилінами здатності проникати всередину клітини клавуланат значно ефективніше амоксициліну діє на внутрішньоклітинно розташовані Legionella pneumophila [10].
Клавуланат також має здатність значно, на 70-80%, зменшувати внутрішньоклітинний пул Chlamydia trachomatis. Активність клавуланата щодо атипових збудників, виявлена in vitro. знайшла своє підтвердження і in vivo на експериментальних моделях пневмонії у мишей, викликаної Chlamydia trachomatis і Legionella pneumophila, причому при легионеллезной пневмонії активність амоксицилін / клавуланату була порівнянна з активністю еритроміцину і доксицикліну.
Також є дані про більш високої активності амоксицилін / клавуланату в порівнянні з амоксициліном щодо штамів периодонтальной флори (Actinobacillus actinomycetemcomitans і Enterococcus faecalis) і E.coli. що не продукують бета-лактамази.
Клінічна ефективність антибіотика залежить не тільки від власне антимікробних властивостей препарату, а й від його взаємодії з факторами імунного захисту макроорганізму. Результати досліджень in vitro продемонстрували посилення захисних властивостей макроорганізму за рахунок підвищення захоплення мікроорганізмів поліморфноядерними клітинами і подальшої загибелі збудника, а також посилення хемотаксису і адгезії поліморфноядерних клітин. Позитивний вплив амоксицилін / клавуланату на імунну відповідь макроорганізму може надавати позитивний вплив і на клінічний результат цих інфекцій, при яких поліморфноядерні клітини є першою лінією захисту [10].
Позитивною властивістю клавуланата є незалежність його ефективності від рН середовища. Крім того, амоксицилін / клавуланат (АМО / К) поєднує властивості інгібітора бета-лактамаз, хорошу біодоступність і широкий спектр антимікробної активності амоксициліну, що робить його на сьогоднішній день єдиним представником інгібіторозахищених пеніцилінів, прийнятних для пероральної терапії. Наявність форми для парентерального введення робить його оптимальним препаратом серед усіх інгібіторзащіщенние пеніцилінів для ступінчастою терапії.
5. Richmond M.H. Sykes R.B. The β-lactamases of Gram-negative bacteria and their possible physiological role // Advances in Microbial Physiology. - 1973. - 9. - 31-88.
6. Lacey R.W. Antibiotic resistance in Staphylococcus aureus and streptococci // British Medical Bulletin. - 1984. - 40. - 77-83.
7. Livermore D.M. Do β-lactamases trap cephalosporins? // Journal of Antimicrobial Chemotherapy. - 1985. - 15. - 511-4.