Процеси адгезії і когезії
Адгезія. Когезия. Змочування і розтікання рідини
Поняття когезії і адгезії. Змочування і розтікання. Робота адгезії і когезії. Рівняння Дюпре. Крайовий кут змочування. Закон Юнга. Гідрофобні і гідрофільні поверхні
У гетерогенних системах розрізняють міжмолекулярної взаємодії всередині фаз і між ними.
Когезія- тяжіння атомів і молекул усередині окремої фази. Вона визначає існування речовини в конденсованому стані і може бути обумовлена міжмолекулярними і міжатомними силами. Поняття адгезії. змочування і розтікання відносяться до міжфазним взаємодій.
Адгезія забезпечує між двома тілами з'єднання певної міцності завдяки фізичним і хімічним міжмолекулярними силами. Розглянемо характеристики когезійний процесу. Робота когезії визначається витратою енергії на зворотній процес розриву тіла по перерізу дорівнює одиниці площі: Wk = 2 × s. де Wk - робота когезії; s- поверхневий натяг
Так як при розриві утворюється поверхня в дві паралельні площі, то в рівнянні з'являється коефіцієнт 2. Когезия відображає міжмолекулярної взаємодії всередині гомогенної фази, то її можна охарактеризувати такими параметрами як енергія кристалічної решітки, внутрішній тиск, летючість, температура кипіння, адгезія результат прагнення системи до зменшення поверхневої енергії. Робота адгезії характеризується роботою оборотного розриву адгезійної зв'язку, віднесеної до одиниці площі. Вона вимірюється в тих же одиницях, що і поверхневий натяг. Повна робота адгезії, яка припадає на всю площу контакту тел: Ws = Wa S
Таким чином, адгезія- робота щодо розриву адсорбційних сил з утворенням нової поверхні в 1 м2.
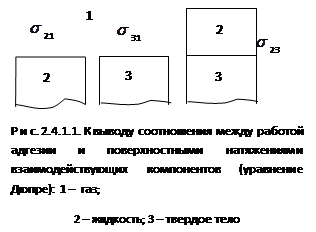
Щоб отримати співвідношення між роботою адгезії і поверхневий натяг взаємодіючих компонентів, уявімо собі дві конденсовані фази 2 і 3, які мають поверхню на кордоні з повітрям 1, рівну одиниці площі (рис. 2.4.1.1).
Будемо вважати, що фази взаємно нерозчинні. При поєднанні цих поверхонь, тобто при нанесенні одного речовини на інше відбувається явище адгезії, тому що система стала двофазної, то з'являється міжфазне натяг s23. В результаті первісна енергія Гіббса системи знижується на величину, рівну роботі адгезії:
Зміна енергії Гіббса системи в процесі адгезії:
m - число молекул в агрегаті;
n - число потенциалопределяющих іонів;
(N-x) - число протиіонів адсорбційного шару;
x - число протиіонів дифузного шару.
Чисельний коефіцієнт 3 перед (n-x) і х поставлений зважаючи трехос-новності аниона AsO3 3.
2. Відповідно до правила Пєскова-Фаянсу-Панета. на поверхні агрегату адсорбуються іони електроліту-стабілізатора, що входять до складу агрегату, або мають загальну природу з ним, або специфічно взаємодіють з ним і знаходяться в надлишку. Іони, що повідомляють агрегату поверхневий заряд, називаються потенціалопределяющего. Агрегат + потенціалопределяющего іони = ядро міцели.
3. Заряд ядра компенсується еквівалентним кількістю протилежно заряджених іонів електроліту-стабілізатора - противоионов. Частина протиіонів, міцно пов'язаних з ядром, входить в адсорбційний шар. Агрегат + адсорбційний шар = колоїдна частка (має заряд).
4. Решта протиіонів утворює дифузний шар.
5. Суми електричних зарядів колоїдної частинки і дифузійного шару дорівнюють один одному по абсолютній величині і протилежні по знаку.
6. Електричний заряд колоїдної частинки дорівнює алгебраїчній сумі електричних зарядів потенциалопределяющих іонів і противоионов адсорбційного шару.
7. Міцела гидрофобного золю є електронейтральної, тобто алгебраїчна сума електричних зарядів іонів всіх верств дорівнює нулю
Для будь-якого типу реакції одне з вихідних речовин беруть в надлишку в порівнянні з стехіометрично необхідним співвідношенням:
Електролітична дисоціація електроліту, взятого в надлишку:
Заряд колоїдної частинки визначається так (правило 6):
Для перевірки правильності запису формули міцели підраховують алгебраїчну суму зарядів всіх іонів (правило 7):
Колоїдна частинка має негативний заряд, міцела в цілому електронейтральна.