Процедура державної реєстрації БАД на території рф
Вибачте, але Ваш браузер не підтримує відтворення цього аудіофайлу. Спробуйте скористатися іншим браузером
Вибачте, але Ваш браузер не підтримує відтворення цього аудіофайлу. Спробуйте скористатися іншим браузером
Процедура державної реєстрації БАД
на території Укаїни
Розглянемо порядок дій юридичної особи (виробника або продавця), який прийняв рішення проводити і / або постачати на ринок Біологічно активну добавку (далі - БАД).
Варто відразу зазначити, що ні організація, уповноважена здійснювати роздрібний продаж БАД (згідно п. 7.4. СанПіН 2.3.2.1290-03. Роздрібна торгівля БАД здійснюється через аптечні установи (аптеки, аптечні магазини, аптечні кіоски та інші), ні спеціалізовані магазини з продажу дієтичних продуктів, продовольчі магазини (спеціальні відділи, секції, кіоски), не візьме БАД на реалізацію без відповідних дозвільних документів, а саме:
- свідоцтва про державну реєстрацію на території Укаїни;
- якісного посвідчення на БАД від Виробника.
Перший документ, з яким стикається Виробник - це СанПіН 2.3.2.1290 - 03 «Гігієнічні вимоги виробництва і обороту біологічно активних добавок до їжі (БАД)». Він визначає ряд основних моментів, що закладають основу подальшої долі БАД, а саме:
- вимоги до технічної документації з виробництва БАД (разделIIIСанПіН 2.3.2.1290 - 03). Тут варто зупинитися і зробити акцент на тому, що не можна взяти цукрову пудру і лимонну кислоту, змішати і зареєструвати як БАД. Подібний продукт буде зупинений ще на стадії експертизи технічної документації: технічних умов (ТУ) та технологічної інструкції (ТІ);
- вимоги до упаковки БАД і інформації, нанесеної на етикетки (разделIVСанПіН 2.3.2.1290 - 03). При подачі БАД на експертизу споживча упаковка повинна бути забезпечена етикету, на яку нанесена регламентована законодавством інформація, в подальшому, якщо БАД пройде успішну реєстрацію, Виробник буде зобов'язаний наносити на кожну етикетку номер свідоцтва про державну реєстрацію та дату його видачі;
- санітарно - епідеміологічні вимоги до виробництва БАД. Цей пункт має відношення перш за все до Виробника. Без отримання санітарно - епідеміологічного висновку, в якому територіальний орган Росспоживнагляду (додаток № 2 до Адміністративного регламенту) дасть позитивну оцінку створеним умовам (простіше кажучи, назве їх «відповідними»), виробництво та реєстрація БАД неможливі.
Отже, Виробник розробив ТУ, ТІ, розробив і виготовив макет етикетки, отримав санітарно - епідеміологічний висновок на виробництво.
Тепер він може приступити до наступної стадії реєстрації БАД: виготовити партію БАД, упакувати її в споживчу упаковку, відповідну СанПіН2.3.2.1290 - 03. наклеїти етикетки відповідно до цього ж нормативним документом, і почати процедуру реєстрації.
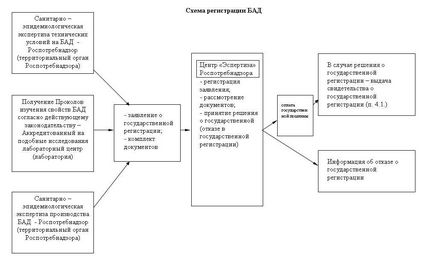
Реєструючий орган (центр «Експертиза» Росспоживнагляду www.crc.ru) наступні документи (Додаток № 5 до Адміністративного регламенту):
- заяву, оформлену відповідно до Додатку 4 до Адміністративного регламенту; - ТУ, ТІ, рецептури на БАД, за якими передбачається здійснювати промислове виготовлення продукції, завірені в установленому законодавством Укаїни порядку;
- якщо ТУ і ТІ Виробника вже пройшли раніше експертизи, необхідно надати санітарно - епідеміологічний висновок про підтвердження, завірене в установленому законодавством Укаїни порядку;
- санітарно - епідеміологічний висновок про відповідність умов виробництва вимогам державних санітарно-епідеміологічних правил і нормативів, завірене в установленому законодавством Укаїни порядку;
- інструкцію із застосування (листок-вкладиш, анотація) (в разі, якщо вся необхідна інформація не може бути розміщена на етикетці), завірену підписом уповноваженої особи та печаткою Виробника;
- споживчу (або тарну) етикетку або її проект, завірений підписом уповноваженої особи та печаткою Виробника;
- протоколи випробувань акредитованих випробувальних лабораторій (центрів), укладення акредитованих організацій (органолептичні, фізико-хімічні, мікробіологічні, радіологічні дослідження (випробування), дослідження допустимого вмісту хімічних, радіологічних, біологічних об'єктів, заборонених компонентів і їх сполук, мікроорганізмів та інших біологічних агентів, які представляють небезпека для здоров'я людини відповідно до державних санітарно-епідеміологічними правилами і нормативами);
- акт відбору зразків (проб) встановленої форми; - при наявності товарного знака - копія свідоцтва на товарний знак, завірена в установленому порядку
- в разі, якщо Виробник і Заявник є різними юридичними особами (або Виробника представляє в органі, що реєструє фізична особа), при подачі заяви і комплекту документів необхідна довіреність Виробника про те, що він довіряє заявнику представляти свої інтереси на території Укаїни щодо здійснення державної реєстрації продукції виробника , а також довіреність на право отримання свідоцтва про державну реєстрацію БАД.
Повертаючись трохи назад, відзначимо, що на руках у нас є всі документи зі списку, крім одного: протоколу випробувань акредитованого випробувального центру (лабораторії).
Експертизи (санітарно-епідеміологічні експертизи, а також дослідження, випробування, токсикологічні, гігієнічні та інші види оцінок), необхідні для державної реєстрації, здійснюються федеральними державними установами - центрами гігієни і епідеміології (перелік установ розміщується на офіційному сайті в мережі Інтернет Федеральної служби з нагляду в сфері захисту прав споживачів і благополуччя людини: www.rospotrebnadzor.ru), іншими організаціями, акредитованими в установленому порядку (перелік організаці й розміщується на офіційному сайті в мережі Інтернет Федерального агентства з технічного регулювання і метрології: www.gost.ru).
ФГУЗ «Федеральний центр гігієни та епідеміології» Росспоживнагляду.
ФГУЗ «Центр гігієни і епідеміології в місті Москві» Росспоживнагляду.
ГУ НДІ медицини праці РАМН (за згодою).
ГУ НДІ екології людини та гігієни навколишнього середовища ім. А.Н. Сисіна РАМН (за згодою).
Федеральний науковий центр гігієни ім. Ф. Ф. Ерісмана Росспоживнагляду.
ГУ НДІ харчування РАМН (за згодою).
Науково-дослідний інститут гігієни та охорони здоров'я дітей і підлітків РАМН (за згодою).
НДІ фізико-хімічної медицини Росздрава (за згодою).
українська медична академія післядипломної освіти Росздрава (за згодою).
ФГУН «Санкт-Петербурзький науково-дослідний інститут радіаційної гігієни імені професора П.В. Рамзаева »Росспоживнагляду.
Зрозуміло, це не скасовує право Виробника звернутися для отримання протоколів випробувань в будь-який інший акредитований на такі дослідження центр або лабораторію, однак вказані в переліку лабораторні центри легітимні і видані ними протоколи безумовно будуть прийняті органом державної реєстрації БАД.
Процедура реєстрації завершена.
1. АДМІНІСТРАТИВНИЙ РЕГЛАМЕНТ
Федеральної СЛУЖБИ ПО НАГЛЯДУ В СФЕРІ ЗАХИСТУ ПРАВ СПОЖИВАЧІВ І БЛАГОПОЛУЧЧЯ ЛЮДИНИ
ВИКОНАННЯ ДЕРЖАВНОЇ ФУНКЦІЇ ПО ДЕРЖАВНУ РЕЄСТРАЦІЮ ВПЕРШЕ впроваджувати у виробництво І РАНІШЕ НЕ використовувати хімічну, БІОЛОГІЧНИХ РЕЧОВИН І виготовляли НА ЇХ ОСНОВІ ПРЕПАРАТІВ, ПОТЕНЦІЙНО НЕБЕЗПЕЧНИХ ДЛЯ ЛЮДИНИ (КРІМ лікарських засобів); ОКРЕМИХ ВИДІВ ПРОДУКЦІЇ, становлять потенційну небезпеку для людини (КРІМ лікарських засобів); ОКРЕМИХ ВИДІВ ПРОДУКЦІЇ, У ТОМУ ЧИСЛІ харчових продуктів, ВПЕРШЕ ввозяться НА ТЕРИТОРІЮ Укаїни (документ MS Word 404 КБ)
2. СанПіН 2.3.2.1078-01.doc (документ MS Word 3 448 КБ).
3. СанПіН 2.3.2.1290-03.doc (документ MS Word 249 КБ).