Приєднання галогеноводородов до алкенам (гідрогалагенірованіе), це хімфак мгу, крихітко!
Інший реакцією електрофільного приєднання до алкенів є приєднання галогеноводородов до алкенам (давно відоме гідрогалогенірованіе алкенов).
Нижче наведені типові приклади приєднання HCl, HBr і HI до різних алкенам:
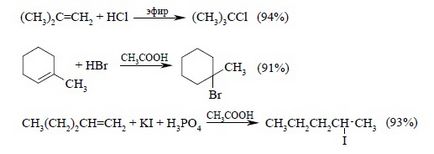
Такі реакції лише на перший погляд здаються простими. Насправді вони мають дуже складний механізм, деталі якого залишаються неясними досі. Вплив алкільних заступників у подвійному зв'язку на швидкість приєднання описується наступною послідовністю:
Це узгоджується з таким механізмом, в якому в визначальною швидкість стадії реакції відбувається утворення карбокатіон, оскільки стабільність алкільних катіонів зростає в ряду: третинний >> вторинний >> первинний. Таким чином, механізм приєднання повинен включати проміжне утворення або вільного карбокатіон, що спостерігається дуже рідко, або интермедиата з карбокатіон характером. Останній випадок найбільш поширений.
Якби приєднання відбувалося через «вільний карбокатіон», то реакція була б зовсім нестереоселектівной, так як алкільні катіони мають плоске будова. Однак, гідрогалогенірованіе, як правило, протікає стереоселективно, причому в залежності від типу алкена може спостерігатися:
1) селективне анти-приєднання
2) селективне син- або змішане син-анти-приєднання
Для алкенів, у яких подвійна зв'язок не пов'язана з ароматичним кільцем, характерно анти-приєдналася галогеноводорода. Анти-приєднання хлористого і бромистого водню, хлористого і бромистого дейтерію спостерігається для циклогексилу циклопентил, 1,2-діметілціклогексена, 1,2-діметілціклопентена, цис- і транс-бутена-2, гексена-3 і багатьох інших простих алкенов і циклоалкеніл. Анти-приєднання несумісне з механізмом, в якому передбачається утворення дискретного карбокатіон. Для плоского карбокатіон нуклеофільних атака галогенид-іона равновероятности по обидва боки площини, що має привести до утворення суміші продуктів анти- і син-приєднання. Кінетика гідрогалогенірованіе алкенов також вказує на більш складний механізм приєднання. Для неспряжених алкенов швидкість реакції, як правило, описується рівнянням третього порядку з другим порядком по галогеноводородами, тобто відповідає AdE3-механізмом:
Анти-приєднання і другий порядок реакції по галогеноводородами узгоджується з механізмом, в якому алкен взаємодіє з двома молекулами галогеноводорода, одна з яких виконує функцію електрофільного, а інша - нуклеофильного агента:
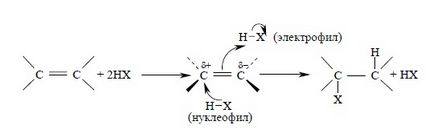
Прийнятні поясненням освіти анти-продукту в тримолекулярного реакції AdE3 є також припущення, що спочатку утворюється молекулярний комплекс алкена з HHal, який потім атакується з анти-сторони другим галогенид-іоном:
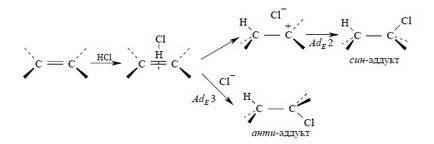
Такий тримолекулярного механізм включає освіту комплексу алкена з однією молекулою галогеноводорода з подальшою нуклеофільної атакою другий молекули HX на цей комплекс без утворення дискретного карбокатіон. Слід особливо відзначити, що будь-який тримолекулярного механізм повинен складатися з двох послідовних стадій, оскільки одночасне зіткнення трьох молекул вкрай малоймовірно.
Анти-приєднання свідчить про кращу нуклеофільної атаці галогеноводорода з боку, протилежної тій, звідки походить протонирование алкена. Замість галогеноводорода функцію нуклеофильного агента може виконувати і галогенид-іон. Дійсно, швидкість реакції зазвичай зростає прямо пропорційно концентрації галогенид-іона, введеного в вигляді галогенідів тетраалкіламонію NR4 + X- або літію. У цьому випадку спостерігається стереоспецифічні анти-приєднання.
Для алканів, у яких подвійний зв'язок пов'язана з ароматичним кільцем характерно син-приєднання або змішане син-анти-приєднання галогеноводорода:
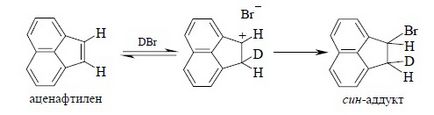
Сін-приєднання є домінуючим процесом для цис- і транс-ізомерів 1-фенілпропіл, 1-феніл-4-алкілціклогексенов, аценафтілена, індена. При протонировании таких алкенов утворюються карбокатіони бензильного типу, які стабільніше чисто алкільних катіонів, що виникають при протонировании звичайних алкенів і циклоалкеніл (див. Гл. 9). Кінетика реакції в цьому випадку зазвичай описується більш простим рівнянням другого порядку: v = k [алкен] [HX], тобто відповідає бімолекулярного AdE2-механізму, який передбачає утворення іонної пари, що включає карбокатіон і галогенид-іон:
Не можна очікувати, що механізм приєднання за участю іонних пар буде відрізнятися високою стереоселективного. Якщо іонна пара перетворюється в кінцевий продукт швидше, ніж відбувається обертання навколо простої вуглець-вуглецевого зв'язку, кінцевим результатом буде син-приєднання, де протон і галогенид-іон приєднуються з однієї і тієї ж сторони подвійного зв'язку. В іншому випадку спостерігається утворення продуктів як син-, так і анти-приєднання HX. Такий випадок реалізується при гідрогалогенірованіе заміщених стиролів Z-C5H5-CH = CH2. Видимий тут закономірність полягає в тому, що син-приєднання характерно лише для тих олефінів, які при протонировании дають відносно стабільний карбокатіон.
Для реакцій гідрогалогенірованіе, що протікають по AdE2-механізму, характерна конкуренція процесів сполученого приєднання і перегрупувань, оскільки в якості інтермедіату утворюється карбокатіон або іонна пара:
Як приклад перегрупувань з 1,2-міграцією алкильной групи і гідрид-іона наведемо реакції гідрогалогенірованіе відповідно трет-бутілетілена і Ізопропілов:
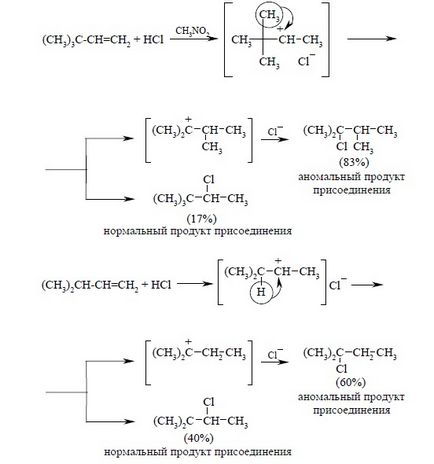
Для реакцій приєднання галогеноводородов до напруженої подвійний зв'язку характерні кісткові перегрупування за участю карбокатіонів як інтермедіатів. Рушійною силою такого роду перегрупувань є утворення більш стабільного або близького по стабільності карбокатіон. Як класичний приклад скелетних перегрупувань можна привести приєднання до норборнену (бицикло [2.2.1] -гептену-2):
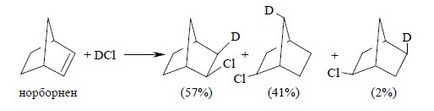
Приєднання DCl до норборнену дає екзо- норборнілхлорід; при цьому близько половини продукту утворюється в результаті скелетної перегрупування норборнілкатіона. Екзо-положення хлору також знаходиться у відповідності з іонним механізмом приєднання. Переважання неперегруппірованного екзо- норборнілхлоріда вказує на те, що велика частина іонних пар дає ковалентний продукт, перш ніж утворюється абсолютно симетрична іонна пара.
Перегрупування, часто спостерігаються при приєднанні галогеноводородов до алкенам і циклоалкеніл, знижують синтетичні можливості і цінність цієї реакції. Більш зручний спосіб отримання вторинних і третинних алкилгалогенидов полягає у взаємодії спиртів з галогеноводородами, тіонілхлоридом або комплексом тріфенілфосфіна з галогеном або чотирьоххлористим вуглецем.