Практичне заняття № 3
Завдання. 1. Отримайте аміак по реакції гідроксиду кальцію з хлоридом амонію.
2. Вивчіть деякі фізичні властивості аміаку (колір, запах, відносну щільність, розчинність в воді).
3. Вивчіть взаємодія аміаку з водою, азотної і соляної кислотами.
4. Виконайте реакції: а) між розчином аміаку у воді і сірчаною кислотою; б) між гідроксидом амонію і розчином хлориду заліза (III).
Дотримуйтесь правил техніки безпеки при проведенні дослідів!
Устаткування. Деталі приладу для отримання аміаку, лабораторний штатив, штатив із пробірками, порцеляновий ступка з товкачиком, ложечка або шпатель, скляні палички (2 шт.), Пробка з власником, нагрівальний прилад.
Речовини. Кристалічні гідроксид кальцію і хлорид амонію; концентрована соляна, концентрована азотна і 20% -я сірчана кислоти; вода (в склянці), розчин фенолфталеїну, розчин хлориду заліза (III).
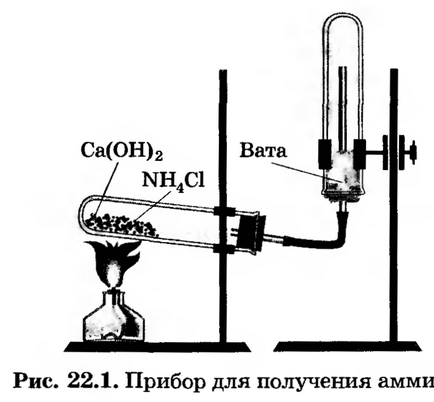
Отримання аміаку. Зберіть прилад для отримання аміаку (рис. 22.1), випробуйте на герметичність. за
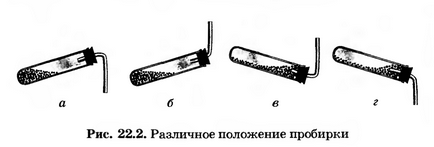
кріпите його в штативі так, щоб зручно було нагрівати пробірку. Вирішіть, яке становище пробірки (рис. 22.2, а, б, в або г) є правильним.
Приготуйте три сухих (чому?) Пробірки, які потрібно наповнити аміаком. Закрийте їх пробками.
У ступку насипте по одній ложечці хлориду амонію і гідроксиду кальцію, перемішайте їх, розітріть товкачем. Потім перенесіть порцію суміші в пробірку приладу, заповнивши її не більше ніж на 1/3.
Почніть нагрівати вміст пробірки, при цьому спочатку обігрів полум'ям пальника всю пробірку, потім полум'я направте так, щоб нагрівалася поверхню суміші.
Наповніть три пробірки аміаком, заткніть їх пробками з власниками; припиніть нагрівання і, не розбираючи приладу, перенесіть його в витяжна шафа.
Вивчення властивостей аміаку.
1. Дослідіть розчинність, взаємодія аміаку з водою. Для цього опустіть пробірку з аміаком в стакан з водою і під водою відкрийте її, як це показано на малюнку 22.3.
Що ви спостерігаєте?
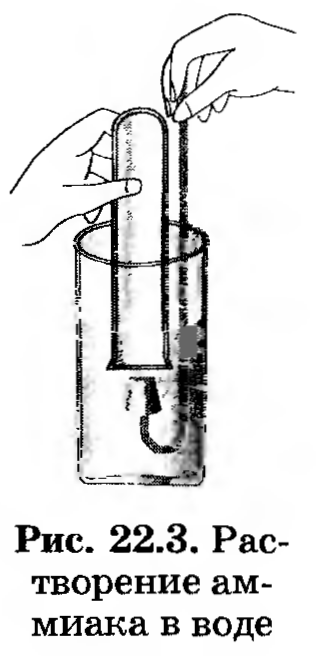
Не виймаючи пробірку, закрийте її також під водою пробкою з власником, після чого поставте в штатив. До отриманого розчину додайте 2-3 краплі розчину фенолфталеїну.
Складіть рівняння реакції взаємодії аміаку з водою.
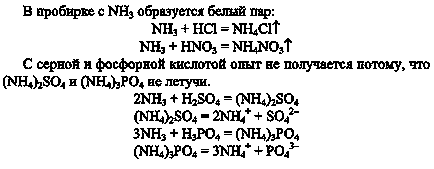
2. Змочіть скляну паличку концентрованою соляною кислотою, іншу - концентрованою азотною кислотою. Внесіть їх по черзі в пробірки з аміаком. Що ви спостерігаєте?
Складіть рівняння реакцій, що.
Чому досвід не вийде при використанні сірчаної та фосфорної кислот?
3. Розлийте отриманий водний розчин аміаку в воді в дві пробірки. В одну пробірку додайте кілька крапель розчину фенолфталеїну і обережно долийте сірчану кислоту до зникнення забарвлення індикатора. Що ви спостерігаєте?
Складіть рівняння реакцій утворення сульфату і гідросульфату амонію.
4. В іншу пробірку з розчином аміаку додайте розчин хлориду заліза (III). Що ви спостерігаєте?
Запишіть іонні рівняння реакцій.
Правильне положення пробірки під б). По-перше, NH3 легше, ніж повітря, він буде підніматися вгору, тому газовідвідна трубка повинна також бути спрямована вгору. По-друге, ми будемо нагрівати речовину в пробірці, тому воно не повинно стикатися з колбою, яка від вогню може розплавитися.
Пробірки повинні бути сухими, тому що аміак реагує з водою і в результаті утворюється гідроксид амонію.
Реакція отримання аміаку:
Вивчення властивостей аміаку:
Аміак добре розчиняється в воді:
Розчин знебарвлюється, оскільки сірчана кислота нейтралізує аміак, тобто середовище стає нейтральною. У нейтральному і кислому середовищі фенолфталеїн безбарвний.