Міозин - це
Мал. 1. Схема молекули міозину: 1-фібріллярнийстержень; 2-головки.
Головки мають грушоподібної форми: довжина їх становить бл. 20 нм, а товщина-9,5 нм на кінці і 5,5 нм в місці прикріплення до стрижневий частини. Остання складається з двох поліпептидних ланцюгів з мовляв. м. ок. 200 тис. У кожній (т. Зв. Важкі ланцюги), закручені спірально одна навколо іншої. В області головок з важкими ланцюгами асоційовані легкі ланцюги-субодиниці з мовляв. м. ок. 20 тис .; на кожну головку припадає дві легкі ланцюги. Мовляв. м. всієї молекули становить бл. 480 тис.
При розщепленні М. короткочасним дією трипсину утворюються два фрагмента, к-які зв. легким і важким мероміозінамі (позначаються соотв. LMM і НММ). LMM являє собою фрагмент стрижневий частини молекули М. довжиною ок. 80 нм і з мовляв. м. 150 тис. НММ містить головку М. і частина хвоста, його довжина 60-70 нм, мовляв. м. ок. 340 тис. При дії папаїном або при довгих. впливі трипсину від молекули М. отщепляются головки (т. зв. субфрагмент 1, або S1 з мовляв. м. 120 тис. Стрижневий фрагмент НММ, к-рий отщепляется при дії папаїну, наз. субфрагмент 2 (S2).
М. володіє АТФазной активністю; каталізує гідроліз АТФ до аденозиндифосфату і Н 3 РО 4 (це св-во М. відкрито В. А. Енгельгардтом і М. Н. Любимова в 1939). Активний центр АТФази М. знаходиться в голівках і зберігає свої каталитич. св-ва при їх протеолітіч. відщепленні. Суттєвими для прояву активності є e-аминогруппа лізину, гуанідинового угруповання аргініну, карбоксильні групи глутамінової та аспарагінової к-т.
У м'язах М. взаємодій. з актином з утворенням а до т о-м і о з і н о в о г о к о м п л е к с а, що грає важливу роль в механізмі скорочення м'язів. Центр, відповідальний за з'єднання з актином, також знаходиться в голівці. З'єднання М. з актином у присутності. іонів Mg 2+ супроводжується багаторазовим збільшенням АТФазной активності. При низькій іонній силі в присутності. АТФ відбувається р-ція суперпреципітації, в результаті до-рій актоміозіновий комплекс стискається і звільняє воду.
Одне з осн. св-в М.-його здатність при низькій іонній силі агрегувати з утворенням добре впорядкованих филаментов, подібних до тих, у вигляді яких брало він присутній в м'язі. Нативний филамент М. є веретеноподібний агрегат діаметром ок. 15 нм і довжиною 1500 нм. Хвости молекул М. упаковані в глиб філамента, а головки виходять назовні у вигляді виступів, регулярно розташованих на пов-сті. У центрі філамента молекули М. агреговані хвіст до хвоста, в результаті чого утворюється зона, що не несе головок. По обидва боки від центру філамента молекули М. агреговані полярно (хвіст до голови). Один филамент містить 300-400 молекул М.
У механізмі м'язового скорочення важливе значення мають ще два білка-тропомиозин і тропонин. Молекула першого (мол. М. 67 тис.) Повністю побудована з a-спіралей і складається з ідентичних по первинній структурі фрагментів, що містять по 42 амінокислотних залишку. У солі середовищі тропомиозин полимеризуется, утворюючи в'язку структуру, що володіє подвійним променезаломлення. При взаємодій. з F-актином молекула тропомиозина укладається в борозенки, утворені подвійною спіраллю актину. Молекула тропонина являє собою комплекс, що складається з трьох білків, -тропоніна Т (мол. М. 37 тис.), Тропоніну I (мол. М. 25 тис.) І тропоніну С (мол. М. 20 тис.). Тропонин I-інгібітор актомиозинового Mg-АТФази, тропонин З здатний до зв'язування іонів Са 2+. тропонин I зв'язується з актином, тропонин Т-с тропо-миозином.
М'язові волокна побудовані з поздовжньо розташованих фібрил (міофібрил) діаметром ок. 1000 Нм, в яких брало чергуються світлі і темні диски (соотв. I і А-диски; рис. 2). В середині диска I розташована пластинка Z, к-раю пронизує все м'язове волокно, утримуючи міофібрили в пучку та впорядковуючи їх розташування. Ділянка між двома сусідніми пластинками Z (т. Зв. C a p к о м е р) - функцією, одиниця міофібрил. Усередині міофібрил знаходяться два види филаментов, орієнтованих паралельно поздовжньої осі м'язи, -філаменти актину і міозину.
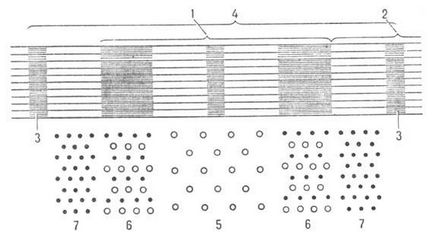
Мал. 2. Схема поздовжнього розрізу ділянки міофібрили (1-диск А, 2-диск I, 3-платівка Z, 4-саркомер); внізупоказана схема поперечного зрізу міофібрили (5-тольконіті міозину, 6-нитки актину і міозину, 7-тільки нитки актину).
Скорочення м'язи здійснюється в результаті ковзання філаментів актину уздовж філаментів М. (рис. 3) завдяки периодич. приєднанню головок М. до актино-вим филаментам і згинання молекули М. в шарнірних ділянках (відбувається "проштовхування" Актинові філаментів). Розслаблення відбувається в результаті розриву поперечних контактів М. і актину і повернення филаментов в початкове положення.
Такий цикл ініціюється надходженням сигналу від нервових закінчень в м'язовому волокні, к-рий обумовлює викид Са 2+ з саркоплазматіч. ретикулума (складна система обмежених мембранами бульбашок, трубочок і т. зв. цистерн, орієнтованих уздовж міофібрил і пронизують м'язові волокна). Іони Са 2+ зв'язуються з тропонином С, агрегованих з актином, і викликають зміну конформації цього білка. В результаті цього тропомиозин переміщається в сторону і не перешкоджає утворенню контактів між головками М. і актином. Коли стан збудження закінчується, Ca 2+ -Mg 2+ -АТФаза саркоплазматіч. ретикулума обумовлює зворотний потік Са 2+ у внутр. простір ретикулума. Коли концентрація Са 2+ досягає досить низького рівня, контакти між головками М. і актином розриваються і м'язове волокно розслабляється. Необхідна енергія для здійснення цього процесу надходить в результаті гідролізу АТФ на М.
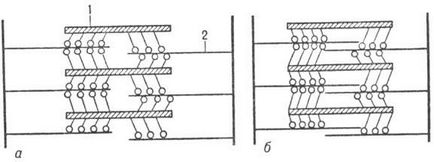
Мал. 3. Схема поперечно м'язи в спокої (а) ІПРІ її скорочення (б); 1 - філаменти міозину; 2 - філаменти актину.
Літ .: Поглазов Б. Ф. Левицький Д. І. Міозин і біологічна рухливість, М. 1982. Б. Ф. Поглазов.
Хімічна енциклопедія. - М. Радянська енциклопедія. Під ред. І. Л. Кнунянц. Тисяча дев'ятсот вісімдесят-вісім.