Лекція органічні речовини
Лекція 2. Органічні речовини. білки
Про рганіческіе з'єднання складають в середньому 20-30% маси клітини живого організму. До них відносяться біологічні полімери - білки, нуклеїнові кислоти і полісахариди, а також жири і ряд низькомолекулярних органічних речовин - амінокислоти, прості цукри, нуклеотиди і т.д. Полімери - складні розгалужені або лінійні молекули, при гідролізі розпадаються до мономерів. Якщо полімер складається з одного виду мономерів, то такий полімер називають гомополімерами. якщо до складу полімерної молекули входять різні мономери - то це гетерополімер. Якщо група різних мономерів в полімерній молекулі повторюється (А, Б, В, А, Б, В, А, Б, В) - це регулярний гетерополімер. якщо немає повторення певної групи мономерів - гетерополімер нерегулярний.
З органічних речовин клітини за кількістю і значенням на першому місці стоять білки. Білки. або протеїни (від грец. протос - перший, головний) - високомолекулярні гетерополімери, органічні речовини і розпадаються при гідролізі до амінокислот. Значення білків настільки велике, що інформація про білки включена в два найбільш популярних визначення Життя: «Життя є спосіб існування білкових тіл, істотним моментом якого є постійний обмін речовин з навколишнім їх зовнішньою природою, причому з припиненням цього обміну речовин припиняється і життя, що призводить до розкладання білка »(Ф. Енгельс). «Живі тіла, що існують на Землі, являють собою відкриті, саморегульовані і самовідтворюються системи, побудованими з біополімерів - білків і нуклеїнових кислот» (М.В.Волькенштейн).
До складу простих білків (що складаються тільки з амінокислот) входять вуглець, водень, азот, кисень і сірка. Частина білків (складні білки) утворює комплекси з іншими молекулами, що містять фосфор, залізо, цинк і мідь - це складні білки, що містять крім амінокислот ще й небілкової - простетичної групу. Вона може бути представлена іонами металів (металопротеїни - гемоглобін), вуглеводами (глікопротеїни), ліпідами (ліпопротеїни), нуклеїновими кислотами (нуклеопротеїнами).
Білки є нерегулярні гетерополімери. мономерами яких є α-амінокислоти. У клітинах і тканинах виявлено понад 170 різних амінокислот, але до складу білків входить лише 20 α-амінокислот. Залежно від того, чи можуть амінокислоти синтезуватися в організмі, розрізняють: замінні амінокислоти - десять амінокислот, синтезованих в організмі і незамінні амінокислоти - амінокислоти, які в організмі не синтезуються. Білки повинні надходити в організм разом з їжею.
Залежно від амінокислотного складу, білки бувають повноцінними. якщо містять весь набір незамінних амінокислот і неповноцінними. якщо якісь незамінні амінокислоти в їх складі відсутні.
Загальна формула амінокислот приведена на малюнку. Все α-амінокислоти при α -атоме вуглецю містять атом водню, карбоксильну групу (-СООН) і аміногрупу (-NH2). Інша частина молекули представлена радикалом.
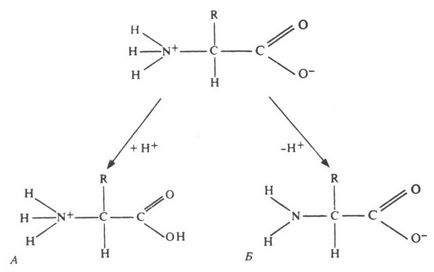
Мал. 255. Амфотерні властивості амінокислот при різних рН.
міногруппа легко приєднує іон водню, тобто проявляє основні властивості. Карбоксильная група легко віддає іон водню - проявляє властивості кислоти. Амінокислоти є амфотерними сполуками, так як в розчині вони можуть виступати як в ролі кислот, так і основ. У водних розчинах амінокислоти існують в різних іонних формах. Це залежить від рН розчину і від того, яка амінокислота: нейтральна, кисла або основна.
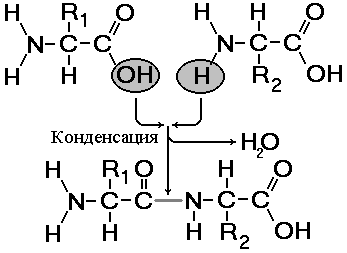
Мал. 256. Освіта дипептида.
Залежно від кількості аминогрупп і карбоксильних груп, що входять до складу амінокислот, розрізняють нейтральні амінокислоти, які мають одну карбоксильну групу і одну аміногрупу, основні амінокислоти, які мають в радикал ще одну аміногрупу і кислі амінокислоти, що мають в радикал ще одну карбоксильну групу.
Пептиди - органічні речовини, що складаються з невеликої кількості залишків амінокислот, з'єднаних пептидним зв'язком. Освіта пептидів відбувається в результаті реакції конденсації амінокислот (рис.).
При взаємодії аміногрупи однієї амінокислоти з карбоксильною групою іншої, між ними виникає ковалентний азот-вуглецевий зв'язок, яку називають пептидного. Залежно від кількості амінокислотних залишків, що входять до складу пептиду, розрізняють дипептиди, трипептиди, тетрапептіди і т.д. Освіта пептидного зв'язку може повторюватися багато разів. Це призводить до утворення поліпептидів. Якщо поліпептид складається з великої кількості залишків амінокислот, то його вже називають білком. На одному кінці молекули знаходиться вільна аміногрупа (його називають N-кінцем), а на іншому - вільна карбоксильна група (його називають С-кінцем).
Структура білкової молекули.
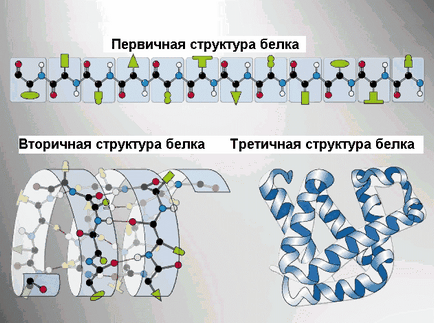
Виконання білками певних специфічних функцій залежить від просторової конфігурації їх молекул, крім того, клітці енергетично невигідно тримати білки в розгорнутій формі, у вигляді ланцюжка, тому поліпептидні ланцюга піддаються укладанні, набуваючи певну тривимірну структуру, або конформацию. Виділяють 4 рівня просторової організації білків.
Первинна структура білка - послідовність розташування амінокислотних залишків у поліпептидному ланцюгу, що становить молекулу білка. Зв'язок між амінокислотами - пептидная.
кщо молекула білка складається всього з 10 амінокислотних залишків, то число теоретично можливих варіантів білкових молекул, що відрізняються порядком чергування амінокислот - 20 10. Білки ж, виділені з живих організмів, утворені сотнями, а іноді й тисячами амінокислотних залишків.
В організмі людини виявлено близько десяти тисяч різних білків, які відрізняються як один від одного, так і від білків інших організмів.
Саме первинна структура білкової молекули визначає властивості молекул білка і її просторову конфігурацію. Заміна всього лише однієї амінокислоти на іншу в поліпептидного ланцюжку призводить до зміни властивостей і функцій білка. Наприклад, заміна в -субодиниці гемоглобіну шостий глутамінової амінокислоти на валін призводить до того, що молекула гемоглобіну в цілому не може виконувати свою основну функцію - транспорт кисню (в таких випадках у людини розвивається захворювання - серповидно анемія).
Першим білком, у якого була виявлена амінокислотна послідовність, став гормон інсулін. Дослідження проводилися в Кембріджському університеті Ф.Сенгером з 1944 по 1954 рік. Було виявлено, що молекула інсуліну складається з двох поліпептидних ланцюгів (21 і 30 амінокислотних залишків), утримуваних близько один одного дисульфідними містками. За свою копітку працю Ф.Сенгер був удостоєний Нобелівської премії.
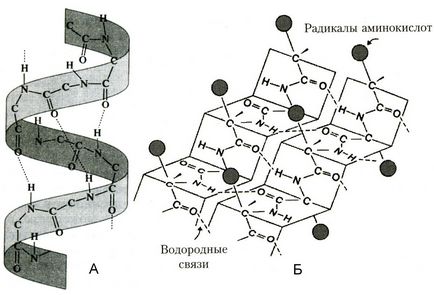
Мал. Вторинні структури білка
торічная структура - впорядковане згортання поліпептидного ланцюга в α-спіраль (має вид розтягнутої пружини) і β-структри (складчастий шар). В α- спіралі NH-група даного залишку амінокислоти взаємодіє з СО-групою четвертого від неї залишку. Практично всі «СО» і «N Н-групи» беруть участь в утворенні водневих зв'язків. Вони слабше пептидних, але, повторюючись багато разів, додають даній конфігурації стійкість і жорсткість. На рівні вторинної структури існують білки: фиброин (шовк, павутина), кератин (волосся, нігті), колаген (сухожилля).
Cкладчатий шар (синонім β-структри) формується в тому випадку, якщо сегменти поліпептидних ланцюгів розташовуються паралельно або антипараллельно один одному в один шар. При цьому утворюється фігура, що нагадує лист, складений гармошкою.
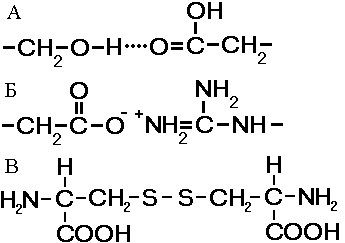
Мал. Зв'язки, що стабілізують третинну структуру:
А - водневі, Б - іонні, В - дисульфідні.
ретічная структура - укладка поліпептидних ланцюгів в глобули. виникає в результаті виникнення хімічних зв'язків (водневих, іонних, дисульфідних) і встановлення гідрофобних взаємодій між радикалами амінокислотних залишків. Основну роль в утворенні третинної структури грають гідрофільно-гідрофобні взаємодії. У водних розчинах гідрофобні радикали прагнуть сховатися від води, групуючи всередині глобули, в той час як гідрофільні радикали в результаті гідратації (взаємодії з диполями води) прагнуть опинитися на поверхні молекули.
У деяких білків третинна структура стабілізується дисульфідними ковалентними зв'язками, що виникають між атомами сірки двох залишків цистеїну. На рівні третинної структури існують ферменти, антитіла, деякі гормони. За формою молекули розрізняють білки глобулярні і фібрилярні. Якщо фібрилярні білки виконують в основному опорні функції, то глобулярні білки розчиняються і виконують безліч функцій в цитоплазмі клітин або у внутрішньому середовищі організму.
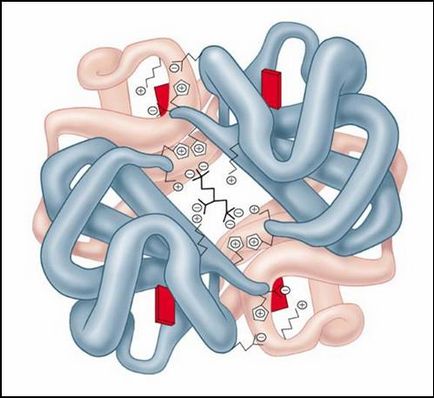
Мал. молекула гемоглобіну
етвертічная структура характерна для складних білків, молекули яких утворені двома і більше глобулами. Субодиниці утримуються в молекулі виключно за допомогою нековалентних зв'язків, в першу чергу водневих і гідрофобних.
Найбільш вивченим білком, що має четвертинних структуру, є гемоглобін. Він утворений двома -субодиницями (141 амінокислотний залишок) і двома -субодиницями (146 амінокислотних залишків) .З кожної субодиницею пов'язана молекула гема, що містить залізо.
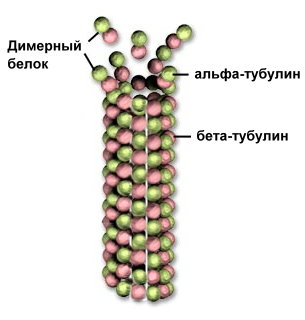
Мал. Микротрубочка з тубуліну
ногие білки з четвертинної структурою займають проміжне положення між молекулами і клітинними органелами - наприклад мікротрубочки цитоскелету складаються з білка тубуліну. що складається з двох субодиниць. Трубочка подовжується в результаті приєднання димарів до торця.
Якщо з яких-небудь причин просторова конформація білків відхиляється від нормальної, білок не може виконувати свої функції
Амінокислотний склад, структура білкової молекули визначають його властивості. Білки поєднують в собі основні і кислотні властивості, які визначаються радикалами амінокислот, чим більше кислих амінокислот у білку, тим яскравіше виражені його кислотні властивості. Здатність віддавати і приєднувати Н + визначають буферні властивості білків, один з найпотужніших буферів - гемоглобін в еритроцитах, що підтримує рН крові на постійному рівні.
Є білки розчинні (фібриноген), є нерозчинні. виконують механічні функції (фиброин, кератин, колаген).
Є білки активні в хімічному відношенні (ферменти), є хімічно неактивні. стійкі до впливу різних умов зовнішнього середовища і вкрай нестійкі.
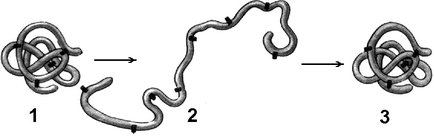
Мал. Денатурація і ренатурації білка:
1 - молекула білка третинної структури; 2 - денатурований білок; 3 - відновлення третинної структури в процесі ренатурації.
нинішні фактори (нагрівання, ультрафіолетове випромінювання, важкі метали і їх солі, зміни рН, радіація, зневоднення) можуть викликати порушення структурної організації молекули білка. Процес втрати тривимірної конформації, властиві даній молекулі білка без руйнування первинної структури, називаютденатураціей.
Причиною денатурації є розрив зв'язків, що стабілізують певну структуру білка. Спочатку рвуться найбільш слабкі зв'язки, а при посиленні умов і сильніші. Тому спочатку втрачається четвертичная, потім третинна і вторинна структури. Зміна просторової конфігурації призводить до зміни властивостей білка і, як наслідок, унеможливлює виконання білком властивих йому біологічних функцій.
Якщо денатурація не супроводжується руйнуванням первинної структури, то вона може бути оборотною. в цьому випадку відбувається самовідновлення властивої білку конформації. Такий денатурації піддаються, наприклад, рецепторні білки мембрани. Процес відновлення структури білка після денатурації називається ренатурацією. Якщо відновлення просторової конфігурації білка неможливо, то денатурація називається незворотною. Руйнування первинної структури білка називається деградацією.
Завдяки складності, різноманітності форм і складу, білки відіграють важливу роль в життєдіяльності клітини і організму в цілому. Функції їх різноманітні.
Людство вступило в нову еру свого існування, коли потенційна сила створюваних ним хімічних, біологічних і фізичних засобів впливу на навколишнє середовище проживання стає сумірною з силами природи.
Функціональна біохімія (зв'язку між будовою речовин і процесами їх видозміни, з одного боку, і функцією органел, клітин, тканин, органів містять ці речовини.
Грунт утворюється на поверхні Землі в тій частині біосфери, де змикаються і проникають одна в одну літосфера, атмосфера і гідросфера, і де щільність живої речовини планети особливо велика.
Перше систематизоване довідкове короткий наукове керівництво по еко-логії людини, що включає в себе близько 2 тис. Термінів і визначень по всьому об'єму питань, пов'язаних з особливостями екосистем «людина-приро-да», «людина-виробництво».
Перше систематизоване довідкове короткий наукове керівництво по еко-логії людини, що включає в себе близько 2 тис. Термінів і визначень по всьому об'єму питань, пов'язаних з особливостями екосистем «людина-приро-да», «людина-виробництво».