лекція №12
Білки - складні біополімери, мономерами яких є -амінокислоти. У складі білків в організмі людини зустрічаються тільки 20-амінокислот. Індивідуальність білків визначається порядком чергування амінокислот у білку. Білки це найважливіший клас біологічних сполук. Вони відіграють ключову роль в клітці, присутні у вигляді головних компонентів в будь-яких формах живої матерії, тому як і раніше незаперечно визначення Ф. Енгельса, що «життя є спосіб існування білкових тіл». Білки надзвичайно різноманітні за структурою і виконують численні біологічні функції. Так в одному організмі Escherichia сolli міститься більше 3000 різних білків.
Назва білки отримали від яєчного білка, який з незапам'ятних часів використовувався в їжу.
Молекулярна маса білків варіює від 5000 до 1млн і більше. Білками є ферменти, гормони, антибіотики, токсини. Білки виконують різноманітні функції: каталітичні (ферменти), рухові (актин, міозин) транспортні (гемоглобін, міоглобін, цитохроми), захисні (імуноглобуліни, антигени, фібриноген), рецепторні (родопсин), регуляторні (гістони, репрессори,) запасають (казеїн, овальбумин) Енергетичну функцію виконують запасають білки або інші в умовах тривалого голодування або інтенсивної тривалої роботи м'язів.
Порівняно невеликі молекули з масою до 5000 називають пептидами, до ні відносять деякі гормони (вазопресин, адренокортикотропний гормон), глюкагон, нейропептиди мозку (ендорфін), пептиди сну, пам'яті, і т.п. алкалоїди (ерготамін) антибіотики (граміцидин)
I. -Амінокислоти
-Амінокислоти - гетерофункціональних сполук, молекули яких містять карбоксильну та аміногрупу у одного і того ж атома вуглецю. У більшості АК, цей атом вуглецю - хіральний центр. В АК, які є мономерами білків, він має відносну - L конфігурацію. Конфігурація визначається за першим Хіральність атому (-вуглець).
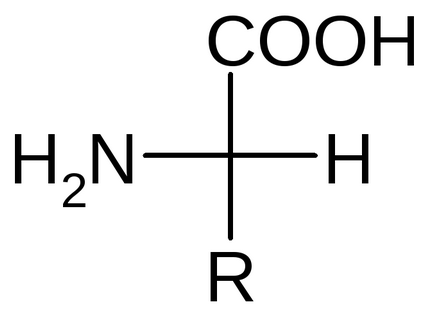
Все -АК мають загальний фрагмент або "стандартний блок" і відрізняються радикалом у -вуглецевого атома. Відсутня радикал тільки у гліцину, у нього замість радикала атом водню.
1. Номенклатура амінокислот і їх класифікація та за будовою радикалів
Назви для АК застосовують переважно тривіальні (гліцин від слова солодкий -glykos, серин від слова serieum - шовковистий, отриманий з фібрину шовку), для запису використовують їх трибуквенне позначення. У складі поліпептидного ланцюжка залишок АК, який не має карбоксильної групи в стандартному блоці називається зі зміною закінчення ИН на іл. Наприклад, гліцил замість гліцин і т.д.
За будовою вуглецевого скелета радикалів АК діляться на аліфатичні, ароматичні і гетероциклічні. У складі радикалів можуть бути функціональні групи, що надають їм специфічні властивості: карбоксильная, аміно-, тіольний, амидная, гидроксильная, гуанідинового. Самі АК все в воді розчинні, але в складі білка властивості радикала впливають на розчинність білка у воді, тому АК з гідрофобними неполярними радикалами формують нерозчинні білки (колаген), АК з гідрофільними полярними радикалами формують розчинні у воді білки (альбуміни). Гідрофобні радикали це вуглеводневі структури, які здатні «склеюватися» один з одним утворюючи гідрофобні зв'язку, але не утворюють водневі зв'язки з водою і тому не розчиняються в ній. До них відносяться радикали з неполярними зв'язками (вуглеводневі радикали). Гідрофільні радикали мають полярні зв'язку і утворюють диполь-дипольні або водневі зв'язку водою. Гідрофобні і гідрофільні радикали АК визначають просторову будову білка, в який вони входять.
Серед полярних радикалів також виділяють з зарядом (позитивно і негативно заряджені), вони краще розчиняються у воді і незаряджені, вони розчиняються у воді гірше.
Таблиця. Будова амінокислот - мономерів білка
1.АК з аліфатичними вуглеводневими радикалами (гідрофобні)