Лабораторна робота 7
Кольорові реакції на білки
Досвід 1.Біуретовая реакція.
Біуретова реакція - якісна на все без винятку білки. а також продукти їх неповного гідролізу. які містять не менше двох пептидних зв'язків.
Принцип методу. Біуретова реакція обумовлена присутністю в білках пептидних зв'язків (- СО - NH -), які в лужному середовищі утворюють з сульфатом міді (ІІ) забарвлені в червоно-фіолетовий колір мідні солеобразние комплекси. Біуретову реакцію дають також деякі небілкові речовини, наприклад біурет (NH2 -CO-NH-CO-NH2), оксамід (NH2 CO-CO-NH2), ряд амінокислот (гістидин. Серин. Треонин. Аспарагин).
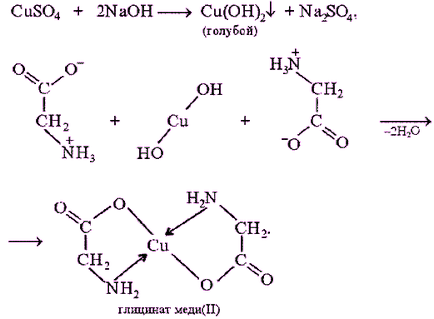
Біуретова реакція з гліцином
Порядок виконання роботи.
До 1 мл досліджуваного 1% розчину білка додають рівний об'єм 10% розчину гідроксиду натрію (NaOH) лугу і потім 2-3 краплі 1% розчину сульфату міді (CuSO4). розведеного, майже безбарвного розчину мідного купоросу.
При позитивній реакції з'являється фіолетове забарвлення з червоним або синім відтінком.
Досвід 2.Реакціяна «слабо зв'язаної сірку».
Принцип методу. Це реакція на цистеїн і цистин. При лужному гідролізі «слабо зв'язаної сірка» в цистеїн і цистині досить легко відщеплюється, в результаті чого утворюється сірководень, який, реагуючи з лугом, дає сульфіди натрію або калію. При додаванні ацетату свинцю (II) утворюється осад сульфіду свинцю (II) сіро-чорного кольору.
Порядок виконання роботи.
У пробірку наливають 1 мл нерозведеного курячого білка, додають 2 мл 20% -го розчину гідроксиду натрію. Суміш обережно кип'ятять (щоб суміш не викинуло).
При цьому виділяється аміак, який виявляється по посиніння вологою лакмусового папірця, піднесеної до отвору пробірки (не торкатися стінки). Утворений незначний осад розчиняється при кипінні, а потім додають 0,5 мл розчину ацетату свинцю (II). Спостерігається випадання сіро-чорного осаду сульфіду свинцю (II):
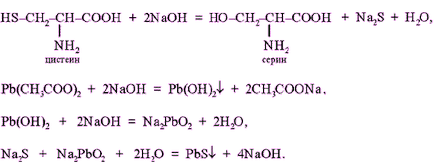
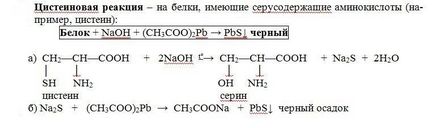
У пробірку наливають 1 мл. нерозбавленого курячого білка додають 2 мл. концентрованого розчину лугу, кладуть кілька кип'ятильників. До гарячого розчину додають розчин плюмбіта натрію - утворюється жовто-буре або чорне забарвлення. (Плюмбіт натрію готують наступним чином: до 1 мл оцтовокислого свинцю додають розчин лугу по краплях до розчинення утворює спочатку осаду гідроксиду свинцю).
При наявності в молекулі білка сірковмісних амінокислот (цистину, цистеїну) з цих амінокислот поступово відщеплюється сірка у вигляді іона в ступені окислення - 2, наявність якого і виявляється іоном свинцю, що створює з іоном сірки чорний нерозчинний сульфід свинцю:
Pb (CH3 COO) 2 + 2NaOH Pb (OH) 2 + 2 CH3 COONa,
Pb (OH) 2 + 2NaOH Na2 PbO2 + H2 O,
Na2 S + Na2 PbO2 + 2H2 O PbS + 4NaOH.
Оформлення досвіду: зробити висновок і написати рівняння реакції.
Досвід 3. Ксантопротеиновая реакція білків.
Принцип методу. Ця реакція використовується для виявлення a-амінокислот, що містять ароматичні радикали. Тирозин, триптофан, фенілаланін при взаємодії з концентрованою азотною кислотою утворюють нітропохідні, мають жовте забарвлення. У лужному середовищі нітропохідні цих a-амінокислот дають солі, пофарбовані в оранжевий колір. Желатин, наприклад, що не містить ароматичних амінокислот, не дає ксантопротеиновой проби.
Порядок виконання роботи.
До 1 мл 10% -го розчину білка курячого яйця додають 0,5 мл концентрованої азотної кислоти. В результаті коагуляції білка у вмісті пробірки утворюється білий осад або помутніння. При нагріванні розчин і осад фарбуються в яскраво-жовтий колір. При цьому осад майже повністю розчиняється в результаті гідролізу. Після охолодження додають 1-2 мл 20% -го розчину гідроксиду натрію (до появи оранжевого забарвлення розчину).
Розглянемо механізм ксантопротеиновой реакції по радикалу тирозину:
Розглянемо механізм ксантопротеиновой реакції по радикалу тирозину:
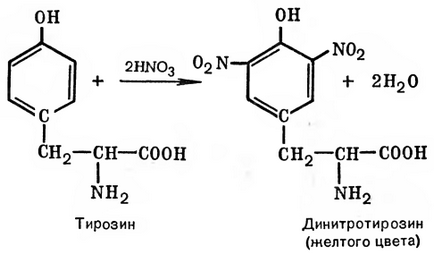
продукт конденсації синьо-фіолетового кольору
Реакція з нингидрином використовується для візуального виявлення a-амінокислот на хроматограмах (на папері, в тонкому шарі), а також для колориметрического визначення концентрації амінокислот за інтенсивністю забарвлення продукту реакції.
Продукт цієї реакції містить в своєму складі радикал (R) вихідної амінокислоти, який обумовлює різне забарвлення: блакитну, червону, і т.д. з'єднань, що виникають при реакції амінокислот з нингидрином.
В даний час Нінгідринова реакція широко використовується як для відкриття окремих амінокислот, так і для визначення їх кількості.
Порядок виконання роботи.
У пробірку наливають 1 мл 1-10% -го розведеного розчину білка курячого яйця і 1-2 мл 1% -го розчину нингидрина в ацетоні. Вміст пробірки перемішують і протягом 2-3 хв обережно нагрівають на водяній бані до появи синьо-фіолетового забарвлення, яке свідчить про присутність в білку α-амінокислот.
Оформлення досвіду: зробити висновок і написати рівняння реакції.
Досвід 2. Висолювання білків хлоридом натрію і сульфатом магнію.
Принцип методу. Для висолювання білків з розчинів застосовуються хлорид натрію, сульфат натрію, ацетат натрію, сульфат магнію, ацетат калію, хлорид кальцію, нітрат кальцію і сульфат амонію. Деякі з перерахованих солей висолюють білки не тільки при насиченні ними розчину; певні білки висаліваются і при досить низьких концентраціях солей. До таких солей відноситься сульфат амонію. Умови, при яких відбувається осадження сульфатом амонію, настільки характерні для окремих білків (за рідкісними винятками), що це властивість білків можна порівняти з розчинністю, що характеризує кристалічні речовини.
Білки складаються з амінокислот і тому мають амфотерними властивостями. При розчиненні білків у воді іон водню, що з'являється в результаті дисоціації карбоксильної групи, приєднується до аміногрупи. Тому білкові молекули несуть як позитивні, так і негативні заряди. Величина заряду визначається кількістю йоногенних груп. При певному значенні рН сумарний електричний заряд молекули білка стає рівним нулю. Таке значення рН називається ізоелектричної точкою (рj). У ізоелектричної точці розчини білків мають мінімальну стійкість, оскільки вони позбавлені основного стабілізуючого фактора - заряду і тому легко випадають в осад. Визначити ізоелектричної точки білка можна, визначивши рН, при якому розчин білка має найбільшу помутніння. У більшості білків ізоелектрична точка лежить в слабокислою середовищі.
Осадження білків NaCl і MgSO4 - Хлорид натрію і сульфат магнію на відміну від сульфату амонію осаджують глобуліни з насиченого розчину. У ізоелектричної точці глобуліни цими ж солями осідають при більш низькій концентрації.
Порядок виконання роботи.
У 2 пробірки наливають по 5 мл 1% розчину білка, додають при перемішуванні до повного насичення (коли частина кристалів залишається нерозчинених, незважаючи на збовтування) в одну пробірку тонко подрібненого хлориду натрію, в іншу - сульфату магнію. Через кілька хвилин в двох пробірках з'являється осад глобулінів. Опади фільтрують і до фільтрату додають кілька крапель розведеної оцтової кислоти (СН3 СООН) - в слабокислою середовищі випадають альбуміни. оскільки рН розчину альбуміну наблизиться до ізоелектричної точці.
У водному розчині білків їх частки є зарядженими і сильно гідратованих, що обумовлює стійкість білкових розчинів. Але при високій концентрації солей, іони яких теж сильно гідратованих, відбувається руйнування водних оболонок білкових молекул і знімається заряд з білкової молекули адсорбуються на ній іонами солі.
В результаті цих двох процесів білкові розчини втрачають стійкість, частки білка злипаються один з одним, укрупнюються і, нарешті, випадає осад.
Оформлення досвіду: отримані результати досвіду записати в зошит і зробити висновок.
Досвід 3. Згортання білків при нагріванні.
Принцип методу. Випадання білків в осад при нагріванні характерно майже для всіх білків (виняток становить желатину, що не згортається при нагріванні). Особливо легко і більш повно відбувається осадження білка в слабокислою середовищі, поблизу від ізоелектричної точки. У нейтральній і сильнокислой середовищах осадження білків йде значно гірше, а в лужному середовищі зовсім не спостерігається.
У лужному середовищі знижується дисоціація білка по радикалам діамінокіслот, молекули його набувають негативний заряд, внаслідок чого залишаються в розчині навіть при нагріванні до кипіння.
Додавання до розчину білка нейтральних солей (NaCl) полегшує і прискорює згортання білків при кип'ятінні внаслідок наступаючого дегідратірованія білкових частинок.
Порядок виконання роботи.
У 5 пробірок наливають по 2 мл. білка: першу пробірку нагрівають, осад з'являється ще до того, як рідина закипить. У другу пробірку додають 1 краплю 1% -ного розчину оцтової кислоти (СН3 СООН) і нагрівають. Пластівчастий осад білка випадає швидше і повніше, ніж в першій пробірці внаслідок того, що при підкисленні рН розчину наблизиться до ізоелектричної точці білка (заряд білка = 0). У третю пробірку додають 0,5 мл. 10% -ної оцтової кислоти (СН3 СООН) і нагрівають. Осаду не утворюється навіть при кипінні. У четверту пробірку додають 0,5 мл. 10% -ної оцтової кислоти (СН3 СООН) і кілька крапель насиченого розчину хлориду натрію і нагрівають. Осад є. У п'яту пробірку додають 0,5 мл. 10% розчину лугу і нагрівають. Осад не утворюється навіть при кип'ятінні. Оформлення роботи.
Результати досвіду і висновки записують в таблицю.
Досвід 5. Осадження білків концентрованими мінеральними кислотами.
Принцип методу. Концентровані мінеральні кислоти викликають незворотні осадження білків. Це пов'язано як з дегідратацією білкових молекул, так і з денатурацією білка.
Концентровані мінеральні кислоти викликають денатурацію білка за рахунок видалення факторів стійкості білка в розчині (заряд і гідратне оболонка), і утворюють комплексні солі білка з кислотами. Ортофосфорна кислота осаду не дає.
В надлишку всіх мінеральних кислот, за винятком азотної, що випав осад білка розчиняється. Мабуть, це відбувається в результаті перезарядки молекул білка і часткового їх гідролізу.
При додаванні надлишку азотної кислоти розчинення осаду не відбувається. Ось чому для визначення малих кількостей білка в сечі при клінічних дослідженнях застосовується азотна кислота (метод Робертса - Стольнікова - Брендберга).
Порядок виконання роботи.
У 3 пробірки наливають по 1 мл. мінеральних кислот: азотної, сірчаної та соляної. Потім обережно по стінці пробірки піпеткою наливають по 0,5 мл. розчину білка, так, щоб він не змішувався з кислотою. У місці зіткнення двох рідин з'являється білий аморфний осад білка.
При струшуванні в пробірці з азотною кислотою осад збільшується, в двох інших пробірках осад розчиняється в надлишку кислот.
Оформлення досвіду: отримані результати досвіду записати в зошит і зробити висновок.
Досвід 7. Випадання білків спиртом
Принцип методу. Тривалий контакт білка зі спиртом веде до необоротного осадженню, денатурації, в результаті цього випадає пластівчастий осад білка внаслідок дегідратації білкових молекул при додаванні спирту.
Під денатурацією розуміють втрату тривимірної конформації, властиві даній білковій молекулі. Ця зміна може носити тимчасовий або постійний характер, але і в тому, і в іншому випадку амінокислотна послідовність білка залишається незмінною. При денатурації молекула розгортається і втрачає здатність виконувати свою звичайну біологічну функцію.
Реакція осадження білка спиртом або короткочасним дією спирту оборотна при охолодженні. Якщо осад швидко відокремити від спирту, то білок може зберегти нативное стан.
Порядок виконання роботи.
У пробірку наливають 1 мл. розчину білка, додають трохи кристалічного хлориду натрію, доливають туди ж поступово 3-4 мл. етилового спирту.