Електроліз водного розчину хлориду натрію
Хімічні процеси, що протікають під дією постійного елек-тричних струму, називаються електрохімічними. Відповідно до першого закону Фарадея, маса речовин, що виділилися на електродах, прямо пропорції-нальна кількості електрики, що пройшов через електроліт.
За другим законом Фарадея, при однаковій кількості електрічест-ва, що пройшов через електроліт, на електродах виділиться еквівалентні маси різних речовин, тобто для виділення на електроді одного еквівалент-стрічка будь-якої речовини необхідно затратити одне і те ж кількість елек-тричества (96500 кулонів), зване числом Фарадея (F).
F = 96500 Кл = 26,8 (ампер-годину).
Теоретичну масу речовини можна обчислити за формулою, об'єд-няющих обидва закони Фарадея:
# 964; - тривалість електролізу, годину;
А - маса іона, г / моль;
F - число Фарадея, Кл;
Е - електрохімічний еквівалент, г / Кл.
Мета роботи: отримати хлор і водень електролізом водного розчи-ра хлориду натрію і використовувати хлорид натрію для отримання хлорного вапна. Дослідити розчин після електролізу.
Реактиви: насичений розчин NaCl, сухий Са (ОН) 2. KI, розчин крохмалю, лакмус, фенолфталеїн, фуксин.
Устаткування: U-подібний електролізер з пористої азбестового пере-містечка, вугільний анод, залізний катод, випрями-тель, амперметр, вольтметр, набір проводів, гумова трубка, хлоркальциевого трубка, пробірки, сірники, лу-чину.
Порядок проведення роботи: збирають установку за схемою, представленої на малюнку 1.
У електролізер заливають розчин хлориду натрію. У хлоркальциевого трубку насипають 2 г гашеного вапна і приєднують до електролізерів. Хлор, проходячи через хлоркальциевого трубку, реагує з гашеним вапном з рівняння:
Спочатку розраховують масу хлору, необхідну для реакції з 2 г гашеного вапна. За розрахованої масі хлору визначають продолжитель-ність електролізу при силі струму 1 або 2 ампера за рівнянням (1). Потім включають прилад в мережу і проводять електроліз протягом розрахованого часу, попутно збираючи водень в пробірку і відчуваючи його. Після за-вершення роботи відключають прилад, від'єднують хлоркальциевого трубку і отриману в ній хлорне вапно перевіряють на присутність активного хлору. Для цього частину вапна присипають до розчину йодиду калію і прилипають-ють розчин крохмалю.
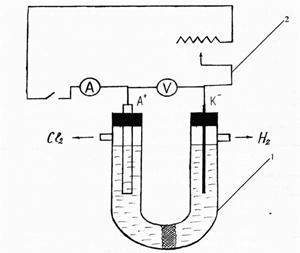
Мал. 1. Схема установки для електролізу хлориду натрію
1 - електролізер з пористої азбестового перегородкою; 2 - випрямляч В-24М.
Далі досліджують катодного і анодное простір на рН середовища. У від-слушні пробірки наливають по 2-3 мл розчину з катодного і анодного простору і додають в них відповідний індикатор.
Оформлення результатів роботи.
1. Напишіть рівняння реакцій електролізу і докази отримано-них продуктів.
2. Наведіть необхідні розрахунки.
3. Опишіть явища, що спостерігаються.
Лабораторна робота № 5