Дефосфорація, окислення фосфору p
Окислення фосфору (дефосфорацию) висловити стехиометрическим рівнянням:
Чіпмен і Вінклер, які вивчали термодинаміку окислення фосфору, замінили, як це часто роблять, активності фосфору в металі концентрацією зважаючи на утворення розведеного розчину. Крім того, вони взяли, що для основних шлаків а 4СаO-P2O5 пропорційна мольной частці N 4СаO-P2O5. а активність СаО визначали як мольну частку окису кальцію (N СаO '), не пов'язаної кислотними оксидами.
Коефіцієнт розподілу фосфору між шлаком і металом, т. Е. Ступінь дефосфорации при постійній температурі, збільшується з підвищенням концентрації катіонів заліза і аніонів кисню в шлаку. Отже, дефосфорация відбувається більш повно зі збільшенням вмісту в шлаку закису заліза (катіони Fе 2+) і основних оксидів (аніони 2).
Чи однаково вплив всіх основних оксидів в шлаку на ступінь дефосфорации? На це питання слід відповісти негативно внаслідок відмінності радіусів катіонів і виникнення в результаті різного взаємодії їх з аніонами мікронеоднорідності шлаку.
Іон РО4 3- характеризується великим радіусом (0,276 нм, або 2,76 а), близьким до радіусу іона SiO4 4- (0,279 нм або 2,79 A), але меншим відношенням заряду до радіусу. Внаслідок цього він ще менш стійкий в оточенні катіонів з відносно малим радіусом і концентрується біля слабких катіонів Са 2+. Тому підвищення вмісту катіонів Са 2+ викликає збільшення стійкості РО4 3- в жужільному розплаві і знижує коефіцієнт активності fРО4 3 це викликає збільшення коефіцієнта розподілу фосфору між шлаком і металом.
Підвищення вмісту в шлаку кислотного оксиду SiO2 викликає зменшення коефіцієнта розподілу фосфору внаслідок зменшення концентрації аніонів кисню і в результаті підвищення коефіцієнта активності іонів РО4 3-. місця яких кремнекіслородние аніони частково займають біля катіонів Са 2+.
Таким чином, можна зробити висновок, що дефосфорации сприяють підвищення концентрації СаО і зниження концентрації SiO2. т. е. підвищення основності шлаку, а також підвищення вмісту FеО в шлаку.
Однак катіони заліза відіграють двояку роль в процесі дефосфорации. Їх позитивна роль випливає з того, що кисень може переходити з шлаку і окисляти фосфор лише одночасно з компенсуючим переходом катіонів заліза з шлаку в метал. Негативна роль катіонів заліза полягає в тому, що в сусідстві з ними іони РО4 3- нестійкі і відповідно активність їх велика. Стійкими вони робляться лише при заміні катіонів заліза катіонами кальцію. Отже, має бути оптимальне співвідношення між концентраціями СаО і FеО в шлаку, при якому ступінь дефосфорации максимальна.
Дослідження підтвердили наявність оптимального відносини (% СаО) / (% FеО) для процесу видалення фосфору з металу. Наприклад, за даними, наведеними на малюнку, найбільша ступінь дефосфорации досягається при величині цього відносини, що дорівнює приблизно 3, і збільшується з підвищенням основності шлаку
У окислювальний період плавки стали в дугових печах реакція окислення фосфору зазвичай досягає рівноваги і зміна складу шлаку викликає зміна в напрямку реакції, яка відповідно до нових умов протікає в бік окислення або в сторону відновлення.
На ступінь дефосфорации стали сильно впливає температура ванни. Як показали результати досліджень, з підвищенням температури коефіцієнт розподілу фосфору між шлаком збільшується, т. Е. Ступінь дефосфорации металу зменшується. Так як при виплавці сталі система метал-шлак зазвичай досягає рівноваги, такий вплив температури проявляється і по ходу плавки.
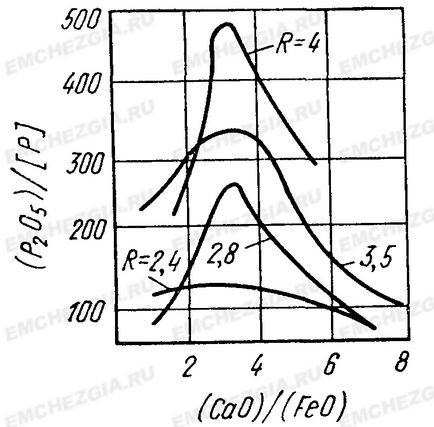
Малюнок 1. Залежність коефіцієнта розподілу фосфору від основності шлаку (R = СаО / SiO2) і відносини (% СаО) / (% FeO)