Число нуклонів в ядрі атома елемента дорівнює відносній атомній масі елемента, округленої до
Водень Ar = 1,001; 1 нуклон
Вуглець Ar = 12,011; 12 нуклонів.
Нукліди, ізотопи, масове число
Більшість елементів, що містяться в природі, складається з декількох видів атомів, що відрізняються значеннями відносної атомної маси.
Приклад. Хлор в природі зустрічається як суміш двох видів атомів, один з яких містить 18, а інший - 20 нейтронів в ядрі.
Кожен вид атомів (вид ядер) називається нуклідом. Нуклід - це вид атомів і ядер, що відповідає певним числам протонів і нейтронів.
Нукліди, що належать одному елементу і однозначно визначаються числом протонів, але різняться за кількістю нейтронів, називаються ізотопними нуклідами. або просто ізотопами.
Ізотопи елемента - це нукліди, що володіють рівним зарядом ядра (числом протонів). Ізотопи елемента розрізняються лише числом нейтронів і, отже, загальним числом нуклонів.
Приклад. Ядра двох природних ізотопів хлору містять по 17 протонів, але 18 і 20 нейтронів, тобто 35 і 37 нуклонів відповідно.
Для нуклідів точні значення відносних атомних мас завжди близькі до цілочисельним значенням, тому маси нуклідів можна порівнювати за цими значеннями, званим масовими числами.
Масове число нукліда дорівнює числу що містяться в ньому нуклонів (сумі протонів і нейтронів).
Для позначення конкретного нуклида застосовується спеціальна символіка. Зліва від символу хімічного елемента верхнім індексом вказується масове число, а нижнім індексом - заряд ядра (порядковий номер елемента). Наприклад, ізотоп хлору-18 записується як.
Масове число = Число нуклонів в ядрі.
Порядковий номер = Число протонів в ядрі або число електронів в оболонці атома.
Різниця між масовим числом і порядковим номером = Число нейтронів в ядрі.
Будова електронної оболонки атома. енергетичні рівні
Будова електронної оболонки атома визначається різним запасом енергії E окремих електронів в атомі. Відповідно до моделі атома Бора електрони можуть займати в атомі положення, яким відповідають точно певні (квантовані) енергетичні стану.
Число електронів, які можуть перебувати на окремому енергетичному рівні, визначається формулою 2n². де n - номер рівня, який позначається арабськими цифрами 1-7; для позначення енергетичних рівнів використовуються також букви від K до Q. Максимальне заповнення перших чотирьох енергетичних рівнів відповідно до формули 2n² становить: для першого рівня К - 2 електрони, для другого L - 8, для третього M - 18 і для четвертого рівня N - 32 електрона.
КВАНТОВО - МЕХАНІЧНА ПОЯСНЕННЯ БУДІВЛІ атома
Орбітальна модель атома
Сучасні квантово-механічні уявлення про будову електронної оболонки атома виходять з того, що рух електрона в атомі не можна описати певною траєкторією. Можна розглядати лише певний обсяг простору, в якому знаходиться електрон. Оскільки електрон має одночасно властивостями частинки і хвилі, то підходом до пояснення будови електронної оболонки може бути як корпускулярна теорія, так і хвильова теорія; обидві вони призводять до однакового наочному уявленню, сформульованому як орбітальна модель атома.
1. Обґрунтування орбітальної моделі атома, що виходить з корпускулярного характеру електрона. полягає в наступному. Як випливає з рис. 2. ймовірність перебування електрона в атомному ядрі дорівнює нулю, вона незначна поблизу ядра, але швидко зростає при видаленні від ядра. На деякій відстані ймовірність досягає максимуму, а потім повільно зменшується, асимптотичне наближаючись до нуля на відстані, яка прагне до нескінченності. Таким чином, неможливо обмежити то простір, в якому може перебувати електрон, тобто не можна (без додаткових умов) вказати розміри атома. Виходячи з корпускулярного характеру електрона можна говорити про 90% -ої ймовірності його перебування в обмеженому обсязі простору, яке називається атомна орбіталь.
Мал. 2. Залежність електронної щільності (або ймовірності перебування електрона на відстані r ядро-електрон) в атомі від відстані від ядра
2. Обгрунтування орбітальної моделі атома, що виходить з хвильового характеру електрона. полягає в наступному. Електрон заповнює простір навколо атомного ядра в формі стоячій хвилі, яку наочно можна уявити як електронне хмара. Щільність електронної хмари, що розуміється як хмара електричного заряду електрона - електронна щільність - виявиться різною і залежить від відстані ядро-електрон (рис.1). При обмеженні електронної щільності до значення
90% виходить та сама орбітальна модель атома.
Атомна орбіталь - це геометричний образ, який відповідає обсягу простору навколо атомного ядра, який відповідає 90% -ої ймовірності знаходження в цьому обсязі електрона (як частки) і одночасно 90% -ої щільності заряду електрона (як хвилі).
Модель атомної орбіталі (електронного хмари) дуже зручна для наочного опису розподілу електронної щільності в просторі. При цьому s-орбіталь має сферичну форму, р-орбіталь - форму гантелі, d-орбіталь - чотирьохпелюсткової квітки або подвоєною гантелі, f-орбіталь - ще більш складну форму (рис. 3).
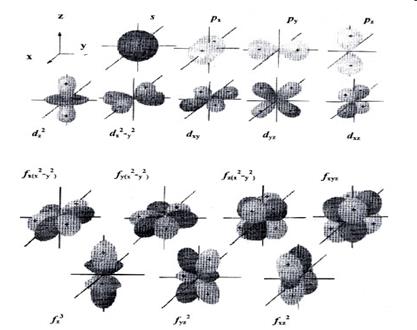
Мал. 3. Форми s-, p-. d- і f -орбіталей
Якщо в атомній орбіталі знаходиться тільки один електрон (як в атомі водню), то говорять про одноразово зайнятої або полузаполненной, полузаселенной атомної орбіталі. Якщо ж в атомній орбіталі знаходяться два електрони (як в атомі гелію), то говорять про дворазово зайнятої або повністю заповненою, повністю заселеній атомної орбіталі. Полузаселенние АТ грають найважливішу роль при формуванні хімічних зв'язків.
Відповідно до квантово-механічним описом стану електрона в атомі кожен електрон є індивідуальною часткою. Такі його властивості, як маса і заряд не виявляють відмінностей між електронами, особливо між тими електронами, які знаходяться на одній атомній орбіталі (як в атомі гелію). Власної характеристикою кожного електрона в атомі є спін.
Два електрона, що знаходяться в одній атомній орбіталі, розрізняються по спину.
Спін - квантово-механічна властивість електрона, яке неможливо точно пояснити за допомогою традиційних уявлень на основі механічної поведінки макрочасток. Без урахування хвильових властивостей електрона спін можна інтерпретувати шляхом порівняння електрона з кулею, що обертається навколо обраної осі. Спін характеризує напрямок обертання і, отже, при двох можливих напрямках механічного обертання повинно існувати два різних спина електрона.
Спін - невід'ємна характеристика електрона в атомі; два електрона на одній атомній орбіталі мають антипаралельними спинами.
Атомну орбиталь зручно зображувати у вигляді квадрата, званого квантової осередком, а кожен електрон - вертикальної стрілкою, що позначає один з двох можливих спинив електрона. Квантова осередок з однією стрілкою означає атомну орбіталь з одним електроном, тобто полузаселенную орбиталь, з двома стрілками - атомну орбіталь з двома електронами, тобто повністю заселену орбиталь, без стрілок - вакантну орбіталь, т. е. без електронів.
Атомну орбиталь, що має кульову симетрію (рис. 3), прийнято позначати як s-орбіталь (s-АТ). а що знаходяться в ній електрони - як s-електрони.
Радіус атомної s-орбіталі зростає при збільшенні номера енергетичного рівня; 1s-АТ розташована всередині 2s-АТ, остання - всередині 3s-АТ і т.д. з центром, який відповідає атомного ядра. В цілому будова електронної оболонки атома в орбітальній моделі представляється шаруватим. Кожен енергетичний рівень, що містить електрони, геометрично розглядається як електронний шар.
Для скороченого позначення електрона, що займає атомну s-орбіталь, використовується позначення самої s-АТ з верхнім цифровим індексом, що вказує число електронів. Наприклад, 1s - позначення єдиного електрона атома водню.
Номер енергетичного рівня відповідає головному квантовому числу, а вид орбіталі - орбітального квантового числа.
2s Li = 1s 2s. Be = 1s 2s
Електронна формула в поєднанні з енергетичної діаграмою електронної оболонки атома (рис. 3) відображають його електронну конфігурацію.
Атомну орбиталь, що має обертальну (осьову) симетрію прийнято позначати як p-орбіталь (p-АТ) (рис. 3); що знаходяться в ній електрони - це p-електронів.
Кожна атомна p-орбіталь може прийняти (при максимальному заповненні) два електрона, подібно будь-який інший АТ. Ці електрони спільно займають обидві половини p орбіталі. На кожному атомному енергетичному рівні (крім першого) є три атомні орбіталі, яким відповідає максимальне заселення шістьма електронами.
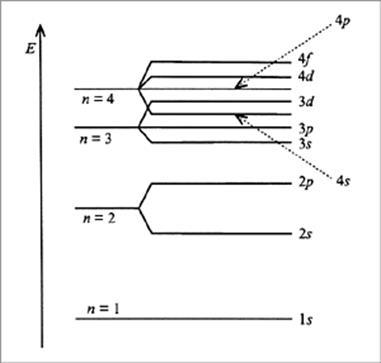
Мал. 4. Діаграма електронних енергетичних станів атома
Всі три p-АТ одного енергетичного рівня відрізняються один від одного просторовим розташуванням; їх власні осі, що проходять через обидві половини орбіталі і перпендикулярні її вузловий площині, утворюють систему декартових координат (позначення власних осей x, y, z). Тому на кожному енергетичному рівні є набір трьох атомних p-орбіталей: px -, py - і pz-АТ. Букви x, y, z відповідають величиною квантового числа. що дозволяє судити про вплив зовнішнього магнітного поля на електронну оболонку атома.
Атомні s-орбіталі є на всіх енергетичних рівнях, атомні p орбіталі - на всіх рівнях, крім першого. На третьому і подальших енергетичних рівнях до однієї s-АТ і трьом p-АТ приєднується п'ять атомних орбіталей, які отримали назву d орбіталей (рис. 4), а на четвертому і наступних рівнях - ще сім атомних орбіталей, званих f -орбіталей.
2.3. енергетичні підрівні
багатоелектронного атома. принципи
побудови електронної оболонки
Квантово-механічні розрахунки показують, що в багатоелектронних атомах енергія електронів одного рівня не однакова; електрони заповнюють атомні орбіталі різних видів і мають різну енергію.
Енергетичний рівень характеризується головним квантовим числом n. Для всіх відомих елементів значення n змінюються від 1 до 7. Електрони в багатоелектронних атомі, що знаходиться в основному (не збудженому) стані, займають енергетичні рівні від першого до сьомого.
Енергетичний підрівень характеризується орбітальним квантовим числом l. Для кожного рівня (n = const) квантове число l приймає всі цілочисельні значення від 0 до (n-1), наприклад, при n = 3 значеннями l будуть 0, 1 і 2. Орбітальний квантове число визначає геометричну форму (симетрію) орбіталей s -, p-, d-, f -подуровня. Очевидно, що у всіх випадках n> l; при n = 3 максимальне значення l дорівнює 2.
Існуючі підрівні для перших чотирьох енергетичних рівнів, числа атомних орбіталей і електронів в них наведені в таблиці 1.
Закономірність заповнення електронних оболонок атомів визначається принципом заборони, встановленим в 1925 р швейцарським фізиком Паулі.
Принцип Паулі. в атомі не можуть перебувати два електрона в тотожних станах.
Різниця електронів, що займають різні атомні орбіталі одного підрівня (n, l = const), крім s-підрівні, характеризується магнітним квантовим числом m. Це число називається магнітним, оскільки воно характеризує поведінку електронів в зовнішньому магнітному полі. Якщо значення l визначає геометричну форму атомних орбіталей підрівні, то значення квантового числа m встановлює взаємне просторове розташування цих орбіталей.