Будова молекули води - гідрогеологія
Вода - одне з найбільш чудових речовин, відомих людині. Вона - єдине природне речовина, що зустрічається у великих кількостях в трьох станах: твердому, рідкому і газоподібному. З усіх поширених рідин вода - найбільш універсальний розчинник, рідина з максимальними величинами поверхневого натягу, діелектричної постійної, теплоти пароутворення і найвищої (після аміаку) теплотою плавлення. На відміну від більшості речовин вода, замерзаючи при низькому тиску, розширюється.
Ці специфічні властивості води пов'язані з особливою будовою її молекули. Хімічна формула води Н2 0 оманливе проста. У молекулі води ядра атомів водню розташовані несиметрично стосовно ядру атома кисню і електронів. Якщо атом кисню знаходиться в центрі тетраедра, центри мас двох атомів водню будуть в кутах тетраедра, а центри зарядів двох пар електронів займуть два інших кута (рис. 3.1). Таким чином, чотири електрона розташовуються на можливо найбільшій відстані як від ядра атома кисню, так і від ядер атомів водню, при якому вони ще притягуються ядром атома кисню. Інші шість електронів молекули води розташовані так: чотири електрона знаходяться в положенні, що забезпечує хімічний зв'язок між ядрами атомів кисню і водню, а два інших розташовані поблизу ядра атома кисню.
Асиметричне розташування атомів молекули води обумовлює нерівномірний розподіл електричних зарядів в ній, що робить молекулу води полярної. Така будова молекули води обумовлює тяжіння молекул води один до одного в результаті утворення між ними водневих зв'язків. Розташування атомів водню і кисню всередині утворилися агрегатів молекул води схоже з розстановкою атомів кремнію і кисню в кварці. Це відноситься до льоду і в меншій мірі до рідкої воді, агрегати молекул якої завжди знаходяться в стадії перерозподілу. При охолодженні води її молекули групуються в агрегати, які поступово збільшуються і стають все більш стійкими в міру наближення до температури 4 ° С, коли вода досягає максимальної щільності. При цій температурі вода ще не має жорсткої структури і поряд з довгими ланцюжками її молекул існує велика кількість окремих молекул води. При подальшому охолодженні ланцюжка молекул води ростуть за рахунок приєднання до них вільних молекул, в результаті чого щільність води зменшується. Коли вода перетвориться на лід, все її молекули входять в більш-менш жорстку структуру в вигляді незамкнутих ланцюжків, що утворюють кристали.
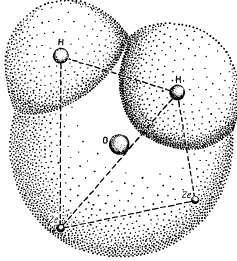
Мал. 3.1. Будова молекули води.
Взаємне проникнення атомів водню і кисню. Ядра двох атомів водню і дві пари електронів перебувають в кутах тетраедра: у центрі розташоване ядро атома кисню.
Високі величини поверхневого натягу і теплоти пароутворення води пояснюються тим, що для відділення молекули води від групи молекул потрібно відносно велика витрата енергії. Прагнення молекул води встановлювати водневі зв'язку та їх полярність пояснюють незвично високу розчиняють здатність води. Деякі сполуки, такі, як цукру і спирти, утримуються в розчині завдяки водневим зв'язкам. Сполуки, які мають високий ступінь іонізації введенні, наприклад хлористий натрій, утримуються в розчині внаслідок того, що іони з протилежними зарядами нейтралізуються групами орієнтованих молекул води.
Відносна поширеність і періоди напіврозпаду ізотопів водню і кисню